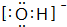题目内容
4.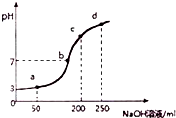 室温时,向100mL0.1mol?L-1NH4Al(SO4)2溶液中滴加0.2mol?L-1NaOH溶液,得到溶液的pH与所加NaOH溶液体积的关系曲线如图所示,下列说法不正确的是( )
室温时,向100mL0.1mol?L-1NH4Al(SO4)2溶液中滴加0.2mol?L-1NaOH溶液,得到溶液的pH与所加NaOH溶液体积的关系曲线如图所示,下列说法不正确的是( )| A. | a、b、c、d四个点,水的电离程度最大的是a | |
| B. | b点溶液中存在c(SO42-)>c(Na+)>c(NH4+) | |
| C. | 在0.1mol?L-1NH4Al(SO4)2溶液中:c(NH4+)+3c(Al3+)=0.199 mol?L-1 | |
| D. | 滴加NaOH溶液期间,溶液中NH4+与SO42-浓度之和始终为0.2mol?L-1 |
分析 A.向100mL0.1mol?L-1NH4Al(SO4)2溶液中滴加0.2mol?L-1NaOH溶液,NH4+、Al3+浓度减小,水解程度减小,则水的电离程度减小;
B.b点溶液为中性,溶质为(NH4)2SO4与Na2SO4、NH3•H2O,V(NaOH)>V(NH4Al(SO4)2);
C.0.1mol?L-1NH4Al(SO4)2溶液pH=3,结合电荷守恒计算;
D.如加入少量NaOH,NH4+与SO42-浓度之和接近0.3mol?L-1.
解答 解:A.a、b、c、d四个点,根据反应量的关系,a点恰好消耗完H+,溶液中只有(NH4)2SO4与Na2SO4;b、c、d三点溶液均含有NH3•H2O,(NH4)2SO4可以促进水的电离,而NH3•H2O抑制水的电离.b点溶液呈中性,所以a点水的电离程度最大,故A正确;
B.b点溶液为中性,溶质为(NH4)2SO4与Na2SO4、NH3•H2O,V(NaOH)>V(NH4Al(SO4)2),铵根离子水解,则离子浓度大小为c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+),故B正确;
C.根据电荷守恒得2c(SO42-)-c(NH4+)-3c(Al3+)=c(H+)-c(OH-)=10-3 mol•L-1,c(NH4+)+3c(Al3+)≈2c(SO42-)-c(H+)=0.199 mol?L-1,故C正确;
D.如加入少量NaOH,NH4+与SO42-浓度之和接近0.3mol?L-1,故D错误.
故选D.
点评 本题考查了离子浓度大小比较、盐类水解等知识点,离子浓度大小比较常常与盐类水解、弱电解质的电离联合考查,确定离子浓度大小时要结合电荷守恒、物料守恒来分析解答,难点是C,知道图象中各个点的溶质即可解答,题目难度中等.

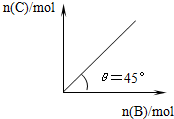 在盛有足量A的体积可变的密闭容器中,加入B,发生反应:
在盛有足量A的体积可变的密闭容器中,加入B,发生反应:A(s)+2B(g)?4C(g)+D(g)△H<0.在一定温度、压强下达到平衡.平衡时C的物质的量与加入的B的物质的量的变化关系如图.下列说法正确的是( )
| A. | 若保持压强一定,当温度升高后,则图中θ>45° | |
| B. | 若再加入B,则正、逆反应速率均逐渐增大 | |
| C. | 平衡时B的转化率为50% | |
| D. | 若保持压强一定,再加入B,则平衡后反应体系气体密度减小 |
| A. | C2H6 | B. | KOH | C. | MgCl2 | D. | CH3COONa |
| 序号 | ① | ② | ③ | ④ |
| 溶液 | NaCl | CH4COONH4 | NaF | NaHCO3 |
| pH | 7.0 | 7.0 | 8.1 | 8.4 |
| A. | 酸性强弱:H2CO3>HF | |
| B. | ①和②中溶质均未水解 | |
| C. | 离子的总浓度:①>③ | |
| D. | ④中:c(HCO3-)+2c(CO32-)+c(H2CO3)=0.1mol/L |
| A. | 该化合物含有离子键和共价键 | |
| B. | 1molO2参与该反应时,得到1mol电子 | |
| C. | 该化合物中阳离子与阴离子个数比为2:1 | |
| D. | O2PtF6的熔点可能比O2低 |
| A. | 1L1mol•L-1的NaClO溶液中含有ClO-的数目为NA | |
| B. | 标准状况下,2.24L CHCl3的分子数为0.1NA | |
| C. | 1L0.1mol•L-1的氨水中有0.1NA个N原子 | |
| D. | 标准状况下,0.1mol Cl2溶于水,转移的电子数目为0.1NA |
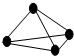 原子间以共价单键相连的非金属单质中,一个原子与相邻原子的成键数为8-N,N为该非金属元素的族序数,化学家把这一现象称为8-N规则.某非金属单质的结构如图所示,则构成该单质的元素位于( )
原子间以共价单键相连的非金属单质中,一个原子与相邻原子的成键数为8-N,N为该非金属元素的族序数,化学家把这一现象称为8-N规则.某非金属单质的结构如图所示,则构成该单质的元素位于( )| A. | ⅢA | B. | ⅣA | C. | ⅤA | D. | ⅥA |
(1)Mg位于元素周期表第三周期第IIA族;N与O的基态原子核外未成对电子个数比为
3:2;Cu的基态原子电子排布式为1s22s22p63s23p63d104s1.
(2)用“>”或“<”填空:
| 碱性: Mg (OH)2> Cu(OH)2 | 第一电离能:O< N | 熔点: MgS< MgO | 稳定性: H2S< H2O |
(4)工业上采取加热条件下用氨气还原氧化铜制取铜,同时得到两种无污染的气体(或蒸汽).写出该反应的化学方程式,并标出电子转移的方向和数目
 .
.