题目内容
3.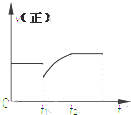 某密闭容器中的反应:3H2(g)+N2$?_{△}^{催化剂}$2NH3(g)△H<0,其正反应速率随时间变化的情况如图所示,判断下列有关t1时刻条件变化的说法可能正确的是( )
某密闭容器中的反应:3H2(g)+N2$?_{△}^{催化剂}$2NH3(g)△H<0,其正反应速率随时间变化的情况如图所示,判断下列有关t1时刻条件变化的说法可能正确的是( )| A. | 增大NH3浓度的同时减小N2浓度 | B. | 增大N2和H2的浓度 | ||
| C. | 扩大容器的体积 | D. | 降低反应温度 |
分析 根据图知,t1时正反应速率减小,且随着反应的进行,正反应速率逐渐增大,说明平衡向逆反应方向移动,当达到平衡状态时,正反应速率大于原来平衡反应速率,说明反应物浓度增大,据此分析解答.
解答 解:根据图知,t1时正反应速率减小,且随着反应的进行,正反应速率逐渐增大,说明平衡向逆反应方向移动,当达到平衡状态时,正反应速率大于原来平衡反应速率,说明反应物浓度增大,
A.t1时减小N2浓度,同时增加了NH3的浓度,平衡向逆反应方向移动,如果增加氨气浓度大于减少氮气浓度的2倍时,达到平衡状态,氮气浓度大于原来浓度,则正反应速率大于原来平衡反应速率,故A正确;
B.t1时增大N2和H2的浓度,平衡向正反应方向移动,但正反应速率在改变条件时刻比原速率快,故B错误;
C.t1时只减小了压强,平衡向逆反应方向移动,则正反应速率增大,但平衡时正反应速率小于原来平衡反应速率,故C错误;
D.t1时只降低了温度,平衡向正反应发现移动,正反应速率逐渐减小,故D错误;
故选A.
点评 本题考查化学平衡图象分析,明确图中反应速率与物质浓度关系是解本题关键,会根据图象曲线变化确定反应方向,题目难度中等.

练习册系列答案
相关题目
13.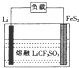 Li-FeS2电池是目前电池中综合性能最好的一种电池,其结构如图所示,已知电池放电时的反应为4Li+FeS2=Fe+2Li2S.下列说法正确的是( )
Li-FeS2电池是目前电池中综合性能最好的一种电池,其结构如图所示,已知电池放电时的反应为4Li+FeS2=Fe+2Li2S.下列说法正确的是( )
 Li-FeS2电池是目前电池中综合性能最好的一种电池,其结构如图所示,已知电池放电时的反应为4Li+FeS2=Fe+2Li2S.下列说法正确的是( )
Li-FeS2电池是目前电池中综合性能最好的一种电池,其结构如图所示,已知电池放电时的反应为4Li+FeS2=Fe+2Li2S.下列说法正确的是( )| A. | Li为电池的正极 | |
| B. | 电池工作时,Li+向负极移动 | |
| C. | 正极的电极反应式为FeS2+4e-=Fe+2S2- | |
| D. | 将熔融的LiCF2SO4改为LiCl的水溶液,电池能更好 |
14.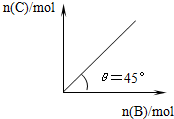 在盛有足量A的体积可变的密闭容器中,加入B,发生反应:
在盛有足量A的体积可变的密闭容器中,加入B,发生反应:
A(s)+2B(g)?4C(g)+D(g)△H<0.在一定温度、压强下达到平衡.平衡时C的物质的量与加入的B的物质的量的变化关系如图.下列说法正确的是( )
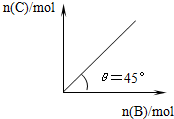 在盛有足量A的体积可变的密闭容器中,加入B,发生反应:
在盛有足量A的体积可变的密闭容器中,加入B,发生反应:A(s)+2B(g)?4C(g)+D(g)△H<0.在一定温度、压强下达到平衡.平衡时C的物质的量与加入的B的物质的量的变化关系如图.下列说法正确的是( )
| A. | 若保持压强一定,当温度升高后,则图中θ>45° | |
| B. | 若再加入B,则正、逆反应速率均逐渐增大 | |
| C. | 平衡时B的转化率为50% | |
| D. | 若保持压强一定,再加入B,则平衡后反应体系气体密度减小 |
11.化学与生活密切相关,下列说法不正确的是( )
| A. | 饮用牛奶和豆浆可以缓解重金属引起的中毒 | |
| B. | 向煤中加入适量石灰石,可减少其燃烧产物中的SO2,降低对大气的污染 | |
| C. | 食品包装袋、食物保鲜膜等材料的主要成分是聚氯乙烯 | |
| D. | 混凝法、中和法和沉淀法是污水处理中常用的化学方法 |
18.化学与生产、生活、社会密切相关,下列说法错误的是( )
| A. | 葡萄糖、麦芽糖均能与银氨溶液反应 | |
| B. | 甘氨酸和丙氨酸缩合最多可以形成四种二肽 | |
| C. | 富含蛋白质的豆浆煮沸后即可得人体所需的氨基酸 | |
| D. | 油酯在氢氧化钾溶液中水解可制得汽车洗涤用的液体肥皂 |
8.下列说法正确的是( )
| A. | 葡萄糖能水解成乙醇和二氧化碳 | |
| B. | 氨基乙酸、甲醛、乙二醇均可发生聚合反应 | |
| C. | 苯酚能跟碳酸钠溶液反应,则苯酚的酸性比碳酸强 | |
| D. | 实验室用溴乙烷在浓硫酸存在并加热条件下制备乙烯 |
15.下列物质不含共价键的是( )
| A. | C2H6 | B. | KOH | C. | MgCl2 | D. | CH3COONa |
12.25℃时,溶液均为0.1mol/L的溶液,其pH如表所示,下列有关说法正确的是( )
| 序号 | ① | ② | ③ | ④ |
| 溶液 | NaCl | CH4COONH4 | NaF | NaHCO3 |
| pH | 7.0 | 7.0 | 8.1 | 8.4 |
| A. | 酸性强弱:H2CO3>HF | |
| B. | ①和②中溶质均未水解 | |
| C. | 离子的总浓度:①>③ | |
| D. | ④中:c(HCO3-)+2c(CO32-)+c(H2CO3)=0.1mol/L |
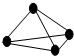 原子间以共价单键相连的非金属单质中,一个原子与相邻原子的成键数为8-N,N为该非金属元素的族序数,化学家把这一现象称为8-N规则.某非金属单质的结构如图所示,则构成该单质的元素位于( )
原子间以共价单键相连的非金属单质中,一个原子与相邻原子的成键数为8-N,N为该非金属元素的族序数,化学家把这一现象称为8-N规则.某非金属单质的结构如图所示,则构成该单质的元素位于( )