题目内容
2.环己酮是重要化工原料,是制造尼龙、己内酰胺和己二酸的主要中间体.实验室常用铬酸氧化环己醇制备,但铬酸较贵且污染环境.某化学兴趣尝试用中学化学更常见的次氯酸钠代替铬酸制备环己酮.有关物质信息、实验流程及实验装置如图1图2:环己酮:无色或浅黄色透明液体,有强烈的刺激性臭味,密度(相对水=1):0.95,熔点:-45℃,沸点:155℃,溶解度(100mL H2O):2.4g(31℃).
主反应:

回答下列问题:
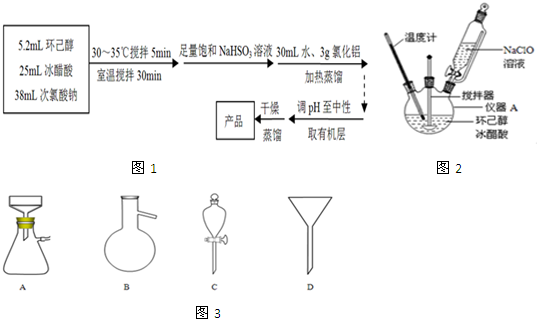
(1)图2中仪器A的名称是三颈烧瓶.
(2)在反应开始的5min,为了将体系温度维持在30~35℃,除了用冰水浴冷却外,采取的措施还有搅拌器搅拌、缓慢滴加NaClO溶液.
(3)加入饱和NaHSO3溶液时发生的主要反应是ClO-+HSO3-═Cl-+H++SO42-(用离子方程式表示),确保加入的饱和NaHSO3溶液已经足量的实验操作是用玻璃棒蘸(或用毛细管吸)取反应液涂在碘化钾淀粉试纸上,若不显蓝色,则NaHSO3溶液已足量.
(4)为将馏出液的pH调至中性,可以加入的试剂是BD.
A、稀盐酸 B、无水碳酸钠 C、浓硫酸 D、氢氧化钠固体
(5)调节pH后还需加入精制食盐,其目的是降低环己酮的溶解度,有利于环己酮分层,“取有机层”时使用的主要仪器是图3中c.(填下图对应的字母).
(6)实验条件的优化对实验成败至关重要,小组成员觉得有必要对NaClO溶液的最佳浓度进行探究.他们配制了一系列不同浓度的NaClO溶液,并用滴定法标定.具体方法是:用移液管取10.00mL NaClO溶液于500mL容量瓶中定容,取25.00mL于锥形瓶中,加入适量稀盐酸和KI固体(足量),用0.1000mol/L Na2S2O3标准溶液滴定至终点(用淀粉溶液作指示剂),三次平行实验平均消耗Na2S2O3标准溶液18.00mL,已知I2+2Na2S2O3═2NaI+Na2S4O6.则该NaClO溶液的浓度是1.800mol/L.
分析 (1)根据实验装置图及常见的仪器分析;
(2)搅拌加速热量传递,NaClO水解吸热;
(3)次氯酸根能将亚硫酸氢根氧化,已经足量时溶液中无次氯酸根,可以用碘化钾淀粉试纸检验是否有次氯酸根;
(4)由(3)中分析可知溶液呈酸性;
(5)环己酮在氯化钠中的溶解度较小,环己酮和水互不相溶;
(6)NaClO溶液中加入适量稀盐酸和KI固体(足量),发生的反应为:ClO-+2I-+2H+=Cl-+I2+H2O,再用0.1000mol/L Na2S2O3标准溶液滴定,发生的反应为:I2+2Na2S2O3═2NaI+Na2S4O6,根据已知反应物质之间的关系计算.
解答 解:(1)由实验装置图可知,图2中仪器A的名称是三颈烧瓶,故答案为:三颈烧瓶;
(2)为了将体系温度维持在30~35℃,要不断搅拌加速热量传递,而且NaClO水解吸热,因此要缓慢滴加NaClO溶液,
故答案为:搅拌器搅拌或缓慢滴加NaClO溶液;
(3)次氯酸根能将亚硫酸氢根氧化生成氯离子、硫酸根离子和氢离子,其离子方程式为:ClO-+HSO3-═Cl-+H++SO42-;已经足量时溶液中无次氯酸根,取反应液涂在碘化钾淀粉试纸上,若不显蓝色,则NaHSO3溶液已足量,
故答案为:ClO-+HSO3-═Cl-+H++SO42-;用玻璃棒蘸(或用毛细管吸)取反应液涂在碘化钾淀粉试纸上,若不显蓝色,则NaHSO3溶液已足量;
(4)由(3)中分析可知溶液呈酸性,可加入无水碳酸钠或氢氧化钠固体,可以使溶液变为中性,
故答案为:BD;
(5)环己酮在氯化钠中的溶解度较小,有利于环己酮分层;环己酮和水互不相溶,可用分液漏斗分离,所以选择的仪器为图3中的c,
故答案为:降低环己酮的溶解度,有利于环己酮分层;c;
(6)设NaClO溶液的浓度是x,
NaClO溶液中加入适量稀盐酸和KI固体(足量),发生的反应为:ClO-+2I-+2H+=Cl-+I2+H2O,
再用0.1000mol/L Na2S2O3标准溶液滴定,发生的反应为:I2+2Na2S2O3═2NaI+Na2S4O6,
则 ClO-~I2 ~2Na2S2O3
1 2
10×10-3×x×$\frac{25}{500}$ 0.1000×18×10-3
解得x=1.800mol/L,
故答案为:1.800mol/L.
点评 本题以环己酮制备为载体,考查化学实验基本操作、离子反应、关系式计算等,题目难度中等,关键根据实验流程利用氧化还原反应判断发生的离子反应,是对学生综合能力的考查.

 名校课堂系列答案
名校课堂系列答案| A. | 葡萄糖、麦芽糖均能与银氨溶液反应 | |
| B. | 甘氨酸和丙氨酸缩合最多可以形成四种二肽 | |
| C. | 富含蛋白质的豆浆煮沸后即可得人体所需的氨基酸 | |
| D. | 油酯在氢氧化钾溶液中水解可制得汽车洗涤用的液体肥皂 |
| A. | 该化合物含有离子键和共价键 | |
| B. | 1molO2参与该反应时,得到1mol电子 | |
| C. | 该化合物中阳离子与阴离子个数比为2:1 | |
| D. | O2PtF6的熔点可能比O2低 |
| A. |  如图装置可用于已知浓度的氢氧化钠溶液滴定未知浓度的盐酸 | |
| B. |  如图装置可用于氯化铵固体和氢氧化钙固体反应制取少量氨气 | |
| C. |  如图装置可用于收集SO2,并吸收多余的SO2 | |
| D. |  如图装置可用于制取少量Cl2 |
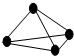 原子间以共价单键相连的非金属单质中,一个原子与相邻原子的成键数为8-N,N为该非金属元素的族序数,化学家把这一现象称为8-N规则.某非金属单质的结构如图所示,则构成该单质的元素位于( )
原子间以共价单键相连的非金属单质中,一个原子与相邻原子的成键数为8-N,N为该非金属元素的族序数,化学家把这一现象称为8-N规则.某非金属单质的结构如图所示,则构成该单质的元素位于( )| A. | ⅢA | B. | ⅣA | C. | ⅤA | D. | ⅥA |
| A. | 强酸和强碱的中和反应的活化能接近于零,所以反应速率很高 | |
| B. | 过程的自发性既能用于判断过程的方向,也能用于判断过程发生的速率 | |
| C. | 电解质溶液导电的过程中,一定发生了电解质溶液的电解 | |
| D. | 溶解度较小的BaSO4在一定条件下也可以转化为溶解度略大的BaCO3 |
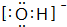
 (1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.已知在
(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.已知在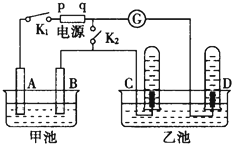 在如图均用石墨作电极的电解池中,甲池中为500mL含某一溶质的蓝色溶液,乙池中为500mL稀硫酸,闭合K1,断开K2进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,立即停止电解,取出A电极,洗涤、干燥、称量,电极质量增重1.6g.请回答下列问题:
在如图均用石墨作电极的电解池中,甲池中为500mL含某一溶质的蓝色溶液,乙池中为500mL稀硫酸,闭合K1,断开K2进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,立即停止电解,取出A电极,洗涤、干燥、称量,电极质量增重1.6g.请回答下列问题: