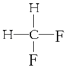
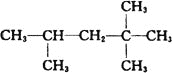
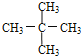题目内容
【题目】银的冶炼有很多方法,在《天工开物》均有记载,而现代流行的“氰化法”,即 用NaCN溶液浸出矿石中的银的方法是常用的方法。该方法具备诸多优点:银的回收率高、对游离态和化合态的银均能浸出、对能源消耗相对较少,生产工艺简便等,但银化物通常有毒。其炼制工艺简介如下:

(1)矿石需要先进行破碎、研磨,其目的是_________。
(2)写出该工艺的一个明显的缺点____________。
(3)用NaCN浸泡矿石(该矿石是辉银矿,其主要成分是Ag2S)时,反应容器处于开口状态,产生的银以[Ag(CN)2]-形式存在,硫元素被氧化至最高价,试写出主要反应的离子方程式________。
(4)银往往和锌、铜、金等矿伴生,故氰化法得到的银中往往因含有上述金属而不纯净,需要进一步纯化,从而获得纯净的银。其中方法之一就是进行电解精炼,在精炼过程中,含有杂质的银作_______极(填“阴”或“阳”),该电极上发生的主要反应式为_____。
(5)有人提出了另外的提纯银的方案,先将锌粉还原后的混合金属用略过量的硝酸溶解,通 过精确调整溶液的pH来进行金属元素逐一分离,已知:
①溶解后的离子浓度如表:
Zn2+ | Cu2+ | Ag+ | |
物质的量浓度(mol/L) | 0.001 | 0.002 | 0.5 |
②某些金属离子的氢氧化物Ksp如表:
Zn2+ | Cu2+ | Ag+ | …… | |
Ksp | 1.0×10-17 | 2.0×10-20 | 2.0×10-8 |
(已知lg2=0.3),该设计方案 ______(填“可行”或“不可行”),其原因是______________。
【答案】增大接触面积,增大反应速率(提高浸出率) NaCN有毒(生成有毒HCN),生产环节不环保,对环境不友好等 Ag2S+4CN-+2O2=2[Ag(CN)2]-+SO42- 阳 Ag-e-=Ag+ 不可行 在调整pH的过程中,各离子的沉淀pH接近,难以逐一沉淀
【解析】
(1)从固态物质对化学反应速率及物质利用率分析;
(2)根据氰化物是有毒物质分析;
(3)根据题意,结合电子守恒、电荷守恒及原子守恒书写方程式;
(4)在金属精炼过程中,不纯金属作阳极,发生氧化反应;
(5)根据溶液中各种离子浓度大小及金属氢氧化物的溶度积常数计算形成沉淀需要的c(OH-)大小分析判断。
(1)矿石是块状固态,将其粉碎、研磨,就可以增大与其他反应物的接触面积,从而可以提高化学反应速率,使更多的物质反应,提高了原料的浸出率;
(2)该冶炼金属银的方法使用了剧毒物质NaCN,对周围环境和操作人员都会形成危害,最后的排出物也容易形成对环境的污染,所以对环境不友好;
(3)用NaCN浸泡矿石(其主要成分是Ag2S)时,反应容器处于开口状态,空气中O2会进入到反应溶液中,产生的银以[Ag(CN)2]-形式存在,硫元素被氧气氧化至最高价的SO42-,根据电子守恒、电荷守恒及原子守恒,可得主要反应的离子方程式为:Ag2S+4CN-+2O2=2[Ag(CN)2]-+SO42-;
(4) 氰化法得到的银中含有杂质,需电解精炼,在精炼过程中,含有杂质的银与电源的正极连接作阳极,阳极发生氧化反应,主要反应式为Ag-e-=Ag+,活动性比Ag强的金属也会失去电子,如Zn-2e-=Zn2+、Cu-2e-=Cu2+;
(5)根据Ksp[Zn(OH)2]=c(Zn2+)c2(OH-)=1.0×10-17,0.001×c2(OH-)=1.0×10-17,c(OH-)=1.0×10-7;
根据Ksp[Cu(OH)2]=c(Cu2+)c2(OH-)=2.0×10-20,0.002×c2(OH-)=2.0×10-20,c(OH-)=3.2×10-9;
根据Ksp(AgOH)=c(Ag+)c(OH-)=2.0×10-8,0.5×c(OH-)=2.0×10-8,c(OH-)=4.0×10-8.可见各种离子形成沉淀需要的pH非常接近,难以逐一沉淀,因此该方法不可行。

【题目】A、B、C、D均为短周期元素,它们在元素周期表中的相对位置如图所示,其中B的单质在空气中含量约占80%。
A | B | C | |||
D |
(1)写出下列元素的名称:C____,D___。
(2)画出B的原子结构示意图____。C在元素周期表中的位置是____。
(3)B、C两种元素最简单氢化物的稳定性由强到弱的顺序是_____。写出A的最简单氢化物的电子式:______。