题目内容
【题目】已知2H2O(g)=2 H2(g)+O2(g) ΔH=+496kJ·mol-1 。断开1 mol H—H键、O=O键分别需要吸收436 kJ、498 kJ的热量,则断开1 molO—H键需要吸收的热量为( )
A. 462 kJB. 469 kJC. 362 kJD. 466.5 kJ
【答案】D
【解析】
根据ΔH=反应物旧键断裂吸收的能量-生成物新键生成放出的能量,设断开1 molO—H键需要吸收的热量为x kJ;
496=4x-2×436-498得x=466.5kJ,因此D正确;
答案:D

 阅读快车系列答案
阅读快车系列答案【题目】定量分析是化学实验中重要的组成部分。
Ⅰ.中和热的测定:在实验室中,用50 mL 0.40 mol/L的盐酸与50 mL 0.50mol/L的NaOH溶液反应测定中和热。假设此时溶液密度均为1 g/cm3,生成溶液的比容热c = 4.18 J/(g℃),实验起始温度为T1℃,终止温度为T2℃,则中和热△H=___kJ/mol。
Ⅱ.氧化还原滴定实验与中和滴定类似。为测定某H2C2O4溶液的浓度,取该溶液于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol/L KMnO4标准溶液滴定。
(1)滴定原理为:(用离子方程式表示)___________。
(2)达到滴定终点时的颜色变化为___________ 。
(3)如图表示50mL滴定管中液面的位置,此时滴定管中液面的___________读数为mL。

(4)为了减小实验误差,该同学一共进行了三次实验,假设每次所取H2C2O4溶液体积均为VmL,三次实验结果记录如下:
实验序号 | ① | ② | ③ |
消耗KMnO4溶液体积/mL | 26.53 | 24.02 | 23.98 |
从上表可以看出,实验①中记录消耗KMnO4溶液的体积明显多于②③,其原因可能是 ______________________。
A.滴加KMnO4溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
B.①滴定盛装标准液的滴定管装液前用蒸馏水清洗过,未用标准液润洗,②③均用标准液润洗
C.实验结束时俯视刻度线读取滴定终点时KMnO4溶液的体积
D.①滴定用的锥形瓶用待测液润洗过,②③未润洗
(5)H2C2O4的物质的量浓度=______________mol/L。
【题目】银的冶炼有很多方法,在《天工开物》均有记载,而现代流行的“氰化法”,即 用NaCN溶液浸出矿石中的银的方法是常用的方法。该方法具备诸多优点:银的回收率高、对游离态和化合态的银均能浸出、对能源消耗相对较少,生产工艺简便等,但银化物通常有毒。其炼制工艺简介如下:
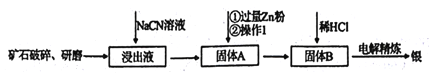
(1)矿石需要先进行破碎、研磨,其目的是_________。
(2)写出该工艺的一个明显的缺点____________。
(3)用NaCN浸泡矿石(该矿石是辉银矿,其主要成分是Ag2S)时,反应容器处于开口状态,产生的银以[Ag(CN)2]-形式存在,硫元素被氧化至最高价,试写出主要反应的离子方程式________。
(4)银往往和锌、铜、金等矿伴生,故氰化法得到的银中往往因含有上述金属而不纯净,需要进一步纯化,从而获得纯净的银。其中方法之一就是进行电解精炼,在精炼过程中,含有杂质的银作_______极(填“阴”或“阳”),该电极上发生的主要反应式为_____。
(5)有人提出了另外的提纯银的方案,先将锌粉还原后的混合金属用略过量的硝酸溶解,通 过精确调整溶液的pH来进行金属元素逐一分离,已知:
①溶解后的离子浓度如表:
Zn2+ | Cu2+ | Ag+ | |
物质的量浓度(mol/L) | 0.001 | 0.002 | 0.5 |
②某些金属离子的氢氧化物Ksp如表:
Zn2+ | Cu2+ | Ag+ | …… | |
Ksp | 1.0×10-17 | 2.0×10-20 | 2.0×10-8 |
(已知lg2=0.3),该设计方案 ______(填“可行”或“不可行”),其原因是______________。