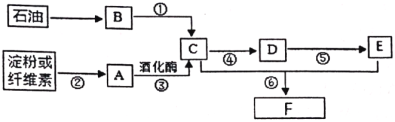
��Ŀ����
����Ŀ����1�����и������ʣ�
A ���ʯ��ʯī��B ��������ά�أ�C ���뮣�D ���������飻 E �����������
F![]() ��
�� G
G  ��
��
���л�Ϊͬλ�� _____�������ţ���ͬ������Ϊͬϵ�����____����Ϊͬ���칹�����______����ͬһ�����ʵ���________��
��2��������A�Ľṹ��ʽΪ�� ����������ȼ��Ʒ�ʿ������ܵIJ��������A��ͬ���칹���к���Ч��ԭ���������ٵ�һ�ֽṹ��ʽΪ��_____����A����ϩ����H2ͨ���ӳɷ�Ӧ�õ������ϩ�������п��ܵĽṹ��ʽΪ_____��
����������ȼ��Ʒ�ʿ������ܵIJ��������A��ͬ���칹���к���Ч��ԭ���������ٵ�һ�ֽṹ��ʽΪ��_____����A����ϩ����H2ͨ���ӳɷ�Ӧ�õ������ϩ�������п��ܵĽṹ��ʽΪ_____��
��3��������ӵļ���ʽ��ͼ��ʾ���Իش�

д��������ӵĻ�ѧʽ________��������ӵ�һ��ȡ���������Ϊ______�֡�
���𰸡�C D EF G CH3C(CH3)2C(CH3)2CH3CH3C��CH3��2C��CH3��2CH3 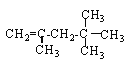
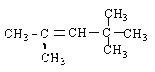 C10H12 4��
C10H12 4��
��������
��1��A ���ʯ��ʯīΪͬ�������壻B ��������ά�ز���ͬ���칹�壻C ���뮻�Ϊͬλ�أ�D ���������黥Ϊͬϵ� E �����������Ϊͬ���칹�壻
F![]() ��
��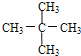 ��Ϊͬ���칹�壻G
��Ϊͬ���칹�壻G 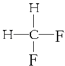 ��
��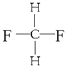 Ϊͬһ���ʣ�
Ϊͬһ���ʣ�
��2��A��ͬ���칹���к���Ч��ԭ���������ٵģ���ͬ���칹��Ϊ�Գƽṹ��Ϊ2��2��3��3-�ļ����飬�ṹ��ʽΪCH3C(CH3)2C(CH3)2CH3��̼̼˫���ӳɵ��ص�Ϊ����̼ԭ���Ͼ�����һ����ԭ�ӣ���ϩ������Ϊ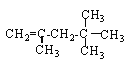
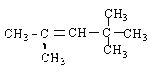 ��
��
��3��������ӵļ���ʽ������λ��ΪC����ÿ��̼ԭ�Ӿ�����4������������Ϊ��ԭ�ӣ������ʽΪC10H12���������Ϊ�Գƽṹ��ͼ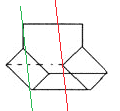 ��2���Գ��ᣬһ��ȡ������4�֡�
��2���Գ��ᣬһ��ȡ������4�֡�

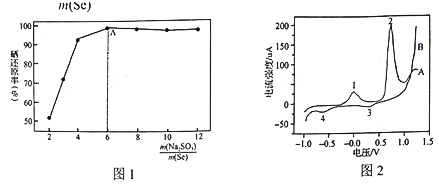
����Ŀ������ұ���кܶ�����ڡ��칤������м��أ����ִ����е����軯�������� ��NaCN��Һ������ʯ�е����ķ����dz��õķ������÷����߱�����ŵ㣺���Ļ����ʸߡ�������̬�ͻ���̬�������ܽ���������Դ������Խ���,�������ռ��ȣ���������ͨ���ж��������ƹ��ռ�����£�
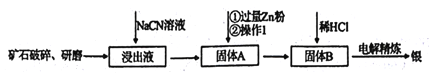
(1)��ʯ��Ҫ�Ƚ������顢��ĥ����Ŀ����_________��
(2)д���ù��յ�һ�����Ե�ȱ��____________��
(3)��NaCN���ݿ�ʯ���ÿ�ʯ�ǻ���������Ҫ�ɷ���Ag2S)ʱ����Ӧ�������ڿ���״̬������������[Ag(CN)2]-��ʽ���ڣ���Ԫ�ر���������ۣ���д����Ҫ��Ӧ�����ӷ���ʽ________��
(4)��������п��ͭ����ȿ���������軯���õ�����������������������������������Ҫ��һ���������Ӷ���ô������������з���֮һ���ǽ��е�⾫�����ھ��������У��������ʵ�����_______��������������������)���õ缫�Ϸ�������Ҫ��ӦʽΪ_____��
(5)���������������ᴿ���ķ������Ƚ�п�ۻ�ԭ��Ļ�Ͻ������Թ����������ܽ⣬ͨ ����ȷ������Һ��pH�����н���Ԫ����һ���룬��֪��
���ܽ�������Ũ�����:
Zn2+ | Cu2+ | Ag+ | |
���ʵ���Ũ��(mol/L) | 0.001 | 0.002 | 0.5 |
��ijЩ�������ӵ���������Ksp���:
Zn2+ | Cu2+ | Ag+ | ���� | |
Ksp | 1.0��10-17 | 2.0��10-20 | 2.0��10-8 |
(��֪lg2=0.3)������Ʒ��� ______(����������������������)����ԭ����______________��