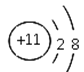题目内容
【题目】A、B、C、D均为短周期元素,它们在元素周期表中的相对位置如图所示,其中B的单质在空气中含量约占80%。
A | B | C | |||
D |
(1)写出下列元素的名称:C____,D___。
(2)画出B的原子结构示意图____。C在元素周期表中的位置是____。
(3)B、C两种元素最简单氢化物的稳定性由强到弱的顺序是_____。写出A的最简单氢化物的电子式:______。
【答案】氟 镁 ![]() 第二周期ⅦA族 HF>NH3
第二周期ⅦA族 HF>NH3 
【解析】
由B的单质在空气中含量约占80%可知B为N元素;由周期表的相对位置可知,A为C元素、C为F元素、D为Mg元素。
(1)由以上分析可知,C为F元素,名称为氟,D为Mg元素,名称为镁,故答案为:氟;镁;
(2)B为N元素,原子核外有7个电子,2个电子层,原子结构示意图为![]() ;C为F元素,位于周期表第二周期ⅦA族,故答案为:
;C为F元素,位于周期表第二周期ⅦA族,故答案为:![]() ;第二周期ⅦA族;
;第二周期ⅦA族;
(3)元素非金属性越强,氢化物的稳定性越强,氟元素的非金属性比氧元素强,则最简单氢化物的稳定性由强到弱的顺序是HF>NH3;A为C元素,最简单氢化物的分子式为CH4,电子式为 ,故答案为:HF>NH3;
,故答案为:HF>NH3; 。
。

 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案【题目】银的冶炼有很多方法,在《天工开物》均有记载,而现代流行的“氰化法”,即 用NaCN溶液浸出矿石中的银的方法是常用的方法。该方法具备诸多优点:银的回收率高、对游离态和化合态的银均能浸出、对能源消耗相对较少,生产工艺简便等,但银化物通常有毒。其炼制工艺简介如下:
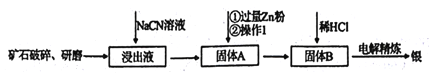
(1)矿石需要先进行破碎、研磨,其目的是_________。
(2)写出该工艺的一个明显的缺点____________。
(3)用NaCN浸泡矿石(该矿石是辉银矿,其主要成分是Ag2S)时,反应容器处于开口状态,产生的银以[Ag(CN)2]-形式存在,硫元素被氧化至最高价,试写出主要反应的离子方程式________。
(4)银往往和锌、铜、金等矿伴生,故氰化法得到的银中往往因含有上述金属而不纯净,需要进一步纯化,从而获得纯净的银。其中方法之一就是进行电解精炼,在精炼过程中,含有杂质的银作_______极(填“阴”或“阳”),该电极上发生的主要反应式为_____。
(5)有人提出了另外的提纯银的方案,先将锌粉还原后的混合金属用略过量的硝酸溶解,通 过精确调整溶液的pH来进行金属元素逐一分离,已知:
①溶解后的离子浓度如表:
Zn2+ | Cu2+ | Ag+ | |
物质的量浓度(mol/L) | 0.001 | 0.002 | 0.5 |
②某些金属离子的氢氧化物Ksp如表:
Zn2+ | Cu2+ | Ag+ | …… | |
Ksp | 1.0×10-17 | 2.0×10-20 | 2.0×10-8 |
(已知lg2=0.3),该设计方案 ______(填“可行”或“不可行”),其原因是______________。
【题目】(1)请填写下表:
物质 | 摩尔质量 | 物质的量 | 质量 | 分子或离子数目 |
SO2 | ________ | 2 mol | ________ | ________ |
SO42- | ________ | ________ | ________ | 6.02×1022 |
O2 | ________ | ________ | 8.0 g | ________ |
(2)O2和O3是氧元素的两种单质。根据分子式回答。等质量的O2和O3所含分子数之比为____,原子个数比为____。
(3)摩尔质量是指单位物质的量的物质所含有的质量。
①已知NH3的相对分子质量为17,则NH3的摩尔质量为____。
②1.28 g某气体含有的分子数目为1.204×1022,则该气体的摩尔质量为____。