题目内容
【题目】I、 向KI和硫酸混合溶液中加入过氧化氢溶液,迅速反应放出大量气泡,溶液呈棕色。
查阅资料知,反应过程如下:
①H2O2+2KI+H2SO4=I2+K2SO4+2H2O;
②H2O2+I2=2HIO;
③H2O2+2HIO=I2+O2↑+2H2O
(1)用双线桥法表示过程①电子转移情况:H2O2+2KI+H2SO4=I2+K2SO4+2H2O_____________。
(2)只比较上述反应②与③,则判断I2起到了___________的作用。
(3)试判断,酸性条件下HIO、H2O2、O2三种物质氧化性的强弱:___________(填化学式)。
II、一定条件下,向含硝酸的废水中加入CH3OH(碳元素为-2价),将HNO3还原成N2。若参加反应的还原剂和氧化剂的物质的量之比是5∶6,则该反应中被氧化的元素的化合价为_____;每转移3 mol电子,反应消耗_____g CH3OH。
【答案】 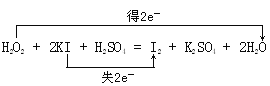 催化剂 H2O2 >HIO>O2 +4价 16
催化剂 H2O2 >HIO>O2 +4价 16
【解析】试题分析:(1)在H2O2+2KI+H2SO4=I2+K2SO4+2H2O中是氧化剂,KI是还原剂,用双线桥分析为: ;
;
(2)②中消耗的I2与③中生成的I2相等,可知I2起到了催化剂的作用;
(3)根据氧化还原反应中氧化剂的氧化性大于氧化产物可知,酸性条件下HIO、H2O2、O2三种物质氧化性的强弱为H2O2>HIO>O2;
II、反应中硝酸为氧化剂,甲醇为还原剂,根据电子转移守恒,令C元素在氧化产物的化合价为a,则:6×5=5×[a-(-2)],解得a=4,故氧化产物为CO2,反应方程式为:5CH3OH+6HNO3=3N2↑+5CO2↑+13H2O,则该反应的氧化产物是CO2;反应中每氧化1molCH3OH转移6mole-,现转移3 mol电子,反应消耗0.5molCH3OH,质量为0.5mol×32g/mol=16g。

 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案 新思维寒假作业系列答案
新思维寒假作业系列答案