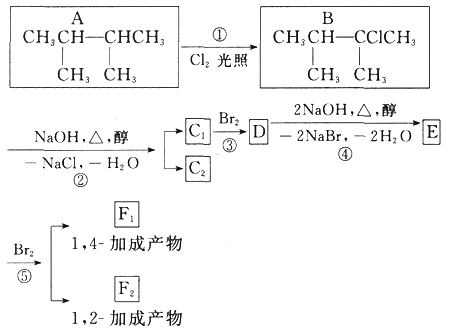
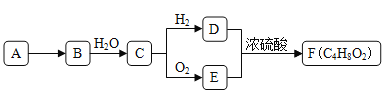
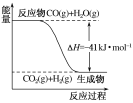
题目内容
【题目】已知无水AlCl3遇潮湿空气即产生大量白雾,实验室可用如图所示装置制备AlCl3。
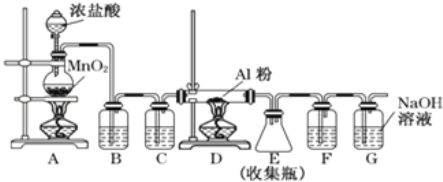
(1)装置A中发生反应的离子方程式为________________________________________
(2)装置B盛放的试剂是______,其作用是_______________________________;装置C盛放的试剂是__________,其作用是__________________________________
(3)装置G的作用是________________,G中发生反应的化学方程式是________________________________________
(4)F中盛放的试剂是______,其作用是___________________________________
【答案】MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O 饱和食盐水 除去Cl2中的HCl气体 浓H2SO4 干燥Cl2(或除去Cl2中的水蒸气) 吸收多余的Cl2,防止污染环境 Cl2+2NaOH═NaCl+NaClO+H2O 浓H2SO4 吸收水蒸气,防止G中水蒸气进入E中使AlCl3遇潮产生白雾
Mn2++Cl2↑+2H2O 饱和食盐水 除去Cl2中的HCl气体 浓H2SO4 干燥Cl2(或除去Cl2中的水蒸气) 吸收多余的Cl2,防止污染环境 Cl2+2NaOH═NaCl+NaClO+H2O 浓H2SO4 吸收水蒸气,防止G中水蒸气进入E中使AlCl3遇潮产生白雾
【解析】
实验室制备AlCl3,用Al粉与干燥的Cl2发生反应,所以,在Cl2进入硬质玻璃管前,需除去Cl2中混有的HCl和水蒸气,同时需防止G中产生的水蒸气进入D装置中,引起AlCl3的水解。在A装置中,MnO2与浓盐酸在加热条件下发生反应:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,生成的Cl2先通入盛有饱和食盐水的B装置,以除去HCl气体,再通过盛有浓硫酸的C装置,以除去Cl2中混有的水蒸气;在D装置中,Cl2与Al反应2Al+3Cl2
MnCl2+Cl2↑+2H2O,生成的Cl2先通入盛有饱和食盐水的B装置,以除去HCl气体,再通过盛有浓硫酸的C装置,以除去Cl2中混有的水蒸气;在D装置中,Cl2与Al反应2Al+3Cl2![]() 2AlCl3;用E装置收集AlCl3,G装置吸收多余的Cl2,F装置中应装有浓硫酸,以防止水蒸气进入E装置。
2AlCl3;用E装置收集AlCl3,G装置吸收多余的Cl2,F装置中应装有浓硫酸,以防止水蒸气进入E装置。
(1)装置A中,MnO2与浓盐酸在加热条件下发生反应:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,发生反应的离子方程式为MnO2+4H++2Cl-
MnCl2+Cl2↑+2H2O,发生反应的离子方程式为MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O。答案为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O。答案为:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(2)装置B需将Cl2中的HCl去除,盛放的试剂是饱和食盐水,其作用是除去Cl2中的HCl气体;装置C需将氯气干燥,盛放的试剂是浓H2SO4,其作用是干燥Cl2(或除去Cl2中的水蒸气)。答案为:饱和食盐水;除去Cl2中的HCl气体;浓H2SO4;干燥Cl2(或除去Cl2中的水蒸气);
(3)Cl2有毒,会污染环境,所以装置G的作用是吸收多余的Cl2,防止污染环境,G中发生反应的化学方程式是Cl2+2NaOH═NaCl+NaClO+H2O。答案为:吸收多余的Cl2,防止污染环境;Cl2+2NaOH═NaCl+NaClO+H2O;
(4)为防水蒸气进入E装置,F中盛放的试剂是浓H2SO4,其作用是吸收水蒸气,防止G中水蒸气进入E中使AlCl3遇潮产生白雾。答案为:浓H2SO4;吸收水蒸气,防止G中水蒸气进入E中使AlCl3遇潮产生白雾。

 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案【题目】硼镁泥是硼镁矿生产硼砂晶体![]() 时的废渣,其主要成分是MgO,还含有
时的废渣,其主要成分是MgO,还含有![]() 、CaO、
、CaO、![]() 、FeO、MnO、
、FeO、MnO、![]() 等杂质。以硼镁泥为原料制取七水硫酸镁的工艺流程如下:
等杂质。以硼镁泥为原料制取七水硫酸镁的工艺流程如下:
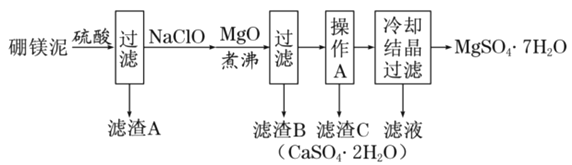
回答下列问题:
(1)![]() 中B的化合价为__________。
中B的化合价为__________。
(2)![]() 易溶于水,也易发生水解:
易溶于水,也易发生水解:![]() 硼酸
硼酸![]() 硼酸在常温下溶解度较小
硼酸在常温下溶解度较小![]() 。写出加入硫酸时
。写出加入硫酸时![]() 发生反应的化学方程式:_____。
发生反应的化学方程式:_____。
(3)滤渣B中含有不溶于稀盐酸但能溶于热浓盐酸的黑色固体,写出生成黑色固体的离子方程式____________。
(4)加入MgO的目的是___________________。
(5)已知![]() 、
、![]() 的溶解度如下表:
的溶解度如下表:
温度 | 40 | 50 | 60 | 70 |
|
|
|
|
|
|
|
|
|
|
“操作A”是将![]() 和
和![]() 混合溶液中的
混合溶液中的![]() 除去,根据上表数据,简要说明“操作A”步骤为____________________。
除去,根据上表数据,简要说明“操作A”步骤为____________________。
(6)硼砂也能在工业上制取![]() ,
,![]() 被称为有机化学中的“万能还原剂”。
被称为有机化学中的“万能还原剂”。
![]() 写出
写出![]() 的电子式:___________。
的电子式:___________。
![]() “有效氢含量”可用来衡量含氢还原剂的还原能力,其定义是:每克含氢还原剂的还原能力相当于多少克
“有效氢含量”可用来衡量含氢还原剂的还原能力,其定义是:每克含氢还原剂的还原能力相当于多少克![]() 的还原能力。
的还原能力。![]() 的有效氢含量为_________
的有效氢含量为_________![]() 保留两位小数
保留两位小数![]() 。
。
![]() 在碱性条件下,在阴极上电解
在碱性条件下,在阴极上电解![]() 也可制得硼氢化钠,写出阴极室的电极反应式:________。
也可制得硼氢化钠,写出阴极室的电极反应式:________。
【题目】已知测定中和热的实验步骤如下:
![]() 量取50mL
量取50mL![]() 硫酸倒入小烧杯中,测量温度;
硫酸倒入小烧杯中,测量温度;
![]() 量取50mL
量取50mL![]() NaOH溶液,测量温度;
NaOH溶液,测量温度;
![]() 将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度.
将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度.
请回答:
(1)![]() 溶液稍过量的原因______.
溶液稍过量的原因______.
(2)加入NaOH溶液的正确操作是______![]() 填字母
填字母![]() .
.
A.沿玻璃棒缓慢加入![]() 一次迅速加入
一次迅速加入![]() 分三次加入
分三次加入
(3)使硫酸与NaOH溶液混合均匀的正确操作是______.
温度 实验次数 | 起始温度 | 终止温度
| 温度差平均值
| ||
| NaOH | 平均值 | |||
1 |
|
|
|
|
|
2 |
|
|
|
|
|
3 |
|
|
|
|
|
(4)设溶液的密度均为![]() ,中和后溶液的比热容
,中和后溶液的比热容![]() ,请根据实验数据求出中和热为______写出该反应的热化学方程式______
,请根据实验数据求出中和热为______写出该反应的热化学方程式______
(5)若将含![]()
![]() 的浓硫酸与含1molNaOH的溶液混合,放出的热量______
的浓硫酸与含1molNaOH的溶液混合,放出的热量______![]() 填“小于”、“等于”或“大于”
填“小于”、“等于”或“大于”![]() ,原因是______.
,原因是______.