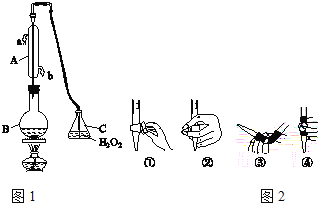
题目内容
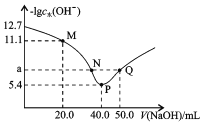
【题目】25°C时, 向一定浓度的Na2C2O4溶液中滴加盐酸,混合溶液的pH与离子浓度变化关系如图所示。已知H2C2O4是二元弱酸,X表示 或
或![]() 下列叙述错误的是
下列叙述错误的是

A.直线n表示pH与- lg 的关系
的关系
B.从M点到N点的过程中,c(H2C2O4)逐渐增大
C.pH= 4.18的混合溶液中: c(Na+)>c(HC2O4-)= c(C2O42-)=(C1-)> c(H+)> c(OH-)
D.由N点可知Kal(H2C2O4)的数量级为10-2
【答案】C
【解析】
A.m、n直线,当lgX =0时,n直线的pH小于m直线上pH值,则说明n点酸性强,则直线n表示pH与lg![]() 的关系,故A正确;
的关系,故A正确;
B.如图所示,从M点到N点,pH不断减小,氢离子浓度增大,因此c(H2C2O4)逐渐增大,故B正确;
C.M点![]() ,因此pH= 4.18的混合溶液中,则
,因此pH= 4.18的混合溶液中,则![]() ,但无法判断c(HC2O4-)= c(C2O42)=c(C1-),故C错误;
,但无法判断c(HC2O4-)= c(C2O42)=c(C1-),故C错误;
D.由N点可知![]() ,因此Kal(H2C2O4)的数量级为102,故D正确。
,因此Kal(H2C2O4)的数量级为102,故D正确。
综上所述,答案为C。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目