题目内容
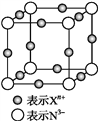
【题目】如图是金属钨晶体中的一个晶胞的结构模型(原子间实际是相互接触的)。它是一种体心立方结构。实验测得金属钨的密度为19.30g·cm-3,钨的相对原子质量为183.9.假定金属钨为等直径的刚性球,请回答以下各题:
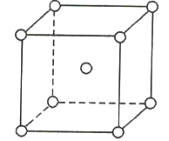
(1)每一个晶胞中分摊到__________个钨原子。
(2)计算晶胞的边长a。_____________
(3)计算钨的原子半径r(提示:只有体对角线上的各个球才是彼此接触的)。___________
(4)计算金属钨原子采取的体心立方密堆积的空间利用率。____________
【答案】2 0.3163nm 0.137nm 68%
【解析】
(1)晶胞中每个顶点的钨原子为8个晶胞所共有,体心钨原子完全为该晶胞所有,故晶胞中钨原子个数为![]() ,故答案为:2;
,故答案为:2;
(2)已知金属钨的密度为ρ,钨的相对原子质量是M,每个晶胞中含有2个钨原子,则每个晶胞的质量为![]() ,又因为每个晶胞的体积为a3,所以晶胞的密度
,又因为每个晶胞的体积为a3,所以晶胞的密度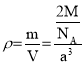 ,解得
,解得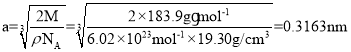 ,故答案为:0.3163nm;
,故答案为:0.3163nm;
(3)晶胞体对角线的长度为钨原子半径的4倍,则![]() ,计算得出钨原子半径为
,计算得出钨原子半径为 ,故答案为:0.137nm;
,故答案为:0.137nm;
(4)每个晶胞中含2个钨原子,钨原子为球状,根据![]() ,则体心立方结构的空间利用率为
,则体心立方结构的空间利用率为 ,故答案为:68%。
,故答案为:68%。

【题目】根据杂化轨道理论和价电子对互斥理论模型判断,下列分子或离子的中心原子的杂化方式及空间构型正确的是( )
选项 | 分子或离子 | 中心原子杂化方式 | 价电子对互斥理论模型 | 分子或离子的空间构型 |
A |
|
| 直线形 | 直线形 |
B |
|
| 平面三角形 | 三角锥形 |
C |
|
| 四面体形 | 平面三角形 |
D |
|
| 四面体形 | 正四面体形 |
A.AB.BC.CD.D
【题目】已知某些共价键的键能如表所示,试回答下列问题:℃
共价键 | 键能 | 共价键 | 键能 |
| 436 |
| 467 |
| 243 |
| 945 |
| 413 |
| 431 |
(1)![]() 键的键能为什么比
键的键能为什么比![]() 键的键能大_______?
键的键能大_______?
(2)已知![]() 在
在![]() 时有
时有![]() 的分子分解,而
的分子分解,而![]() 在
在![]() 时可能完全分解为
时可能完全分解为![]() 和
和![]() ,试解释其中的原因_______。
,试解释其中的原因_______。
(3)试解释氮气能在空气中稳定存在的原因_______。
【题目】![]() 、
、![]() 、
、![]() 、
、![]() 是元素周期表前四周期中的四种常见元素,其相关信息如下表:
是元素周期表前四周期中的四种常见元素,其相关信息如下表:
元素代号 | 相关信息 |
|
|
| 常温常压下, |
|
|
|
|
(1)![]() 位于元素周期表第__________周期第__________族。
位于元素周期表第__________周期第__________族。
(2)![]() 是一种常用的溶剂,
是一种常用的溶剂,![]() 的分子中存在个
的分子中存在个![]() 键。在
键。在![]() 、
、![]() 两种共价键中,键的极性较强的是_____________,键长较长的是___________。
两种共价键中,键的极性较强的是_____________,键长较长的是___________。
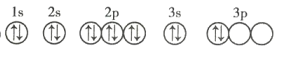
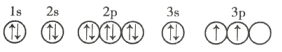
(3)写出![]() 元素的原子核外电子排布式:__________。
元素的原子核外电子排布式:__________。