题目内容
19.A、B、C三种元素的原子具有相同的电子层数,而B的核电荷数比A大2,C原子的电子总数比B原子的电子总数多4; 1molA的单质能跟盐酸反应,在标准状况下可置换出11.2L的H2,这时A转变为与氖原子具有相同电子层结构的离子.试回答:(1)B的原子结构示意图是
 ,与B的离子具有相同电子数的微粒中,有一种分子可与盐酸化合生成一种盐,该反应的化学方程式是NH3+HCl═NH4Cl;
,与B的离子具有相同电子数的微粒中,有一种分子可与盐酸化合生成一种盐,该反应的化学方程式是NH3+HCl═NH4Cl;(2)A、C元素形成化合物的电子式是
 ,周期表中与C上下相邻的同主族元素形成的气态氢化物中,稳定性最强的是HF(填氢化物化学式).
,周期表中与C上下相邻的同主族元素形成的气态氢化物中,稳定性最强的是HF(填氢化物化学式).(3)写出A、B最高正价氧化物对应的水化物之间反应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O.
分析 A、B、C三种元素的原子具有相同的电子层数,而B的核电荷数比A大2,C原子的电子总数比B原子的电子总数多4,1molA的单质能跟盐酸反应,在标准状况下可置换出11.2L的H2,氢气的物质的量是0.5mol,根据转移电子相等知,A是第IA族元素,这时A转变为与氖原子具有相同电子层结构的离子,则A是Na元素,B是Al元素,C是Cl元素,据此进行解答.
解答 解:A、B、C三种元素的原子具有相同的电子层数,而B的核电荷数比A大2,C原子的电子总数比B原子的电子总数多4,1molA的单质能跟盐酸反应,在标准状况下可置换出11.2L的H2,氢气的物质的量是0.5mol,根据转移电子相等知,A是第IA族元素,这时A转变为与氖原子具有相同电子层结构的离子,则A是Na元素,B是Al元素,C是Cl元素.
(1)B为Al元素,铝原子的核电荷数为13,含有3个电子层,最外层有3个电子,所以其原子结构示意图为 ;与B的离子具有相同电子数的微粒中,有一种分子可与盐酸化合生成一种盐,则该分子是氨气分子,氨气和盐酸反应生成氯化铵,所以该反应的化学方程式为NH3+HCl═NH4Cl,
;与B的离子具有相同电子数的微粒中,有一种分子可与盐酸化合生成一种盐,则该分子是氨气分子,氨气和盐酸反应生成氯化铵,所以该反应的化学方程式为NH3+HCl═NH4Cl,
故答案为: ;NH3+HCl═NH4Cl;
;NH3+HCl═NH4Cl;
(2)A和C是形成的化合物是氯化钠,属于离子化合物,其电子式为 ;元素的非金属性越强,其气态氢化物越稳定,同一主族元素中,元素的非金属性随着原子序数的增大而减小,周期表中与C上下相邻的同主族元素形成的气态氢化物中,稳定性最强的是HF,
;元素的非金属性越强,其气态氢化物越稳定,同一主族元素中,元素的非金属性随着原子序数的增大而减小,周期表中与C上下相邻的同主族元素形成的气态氢化物中,稳定性最强的是HF,
故答案为: ;HF;
;HF;
(3)A的最高价氧化物的水化物是氢氧化钠,B的最高价氧化物的水化物是氢氧化铝,氢氧化铝能和强碱反应生成盐和水,所以其离子方程式为Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O.
点评 本题考查了位置结构和性质的相互关系,题目难度中等,正确推断元素是解本题关键,氢氧化铝和氢氧根离子反应方程式的书写是常考查点,也是易错点.

| A. | 平均反应速度:乙>甲 | B. | 平衡时SO3的物质的量甲>乙 | ||
| C. | 平衡时SO2的转化率:乙>甲 | D. | 平衡时混合气体的密度甲<乙 |
| A. | 化学反应中的能量变化通常表现为热量的变化 | |
| B. | 吸热反应一定需要加热的条件 | |
| C. | 化学键的断裂和形成是化学反应中能量变化的主要原因 | |
| D. | 反应物和生成物总能量的相对大小决定化学反应放出还是吸收能量 |
| A. | 冬天,块状的锌与2mol/L稀硫酸溶液反应 | |
| B. | 冬天,粉末状的锌与2mol/L稀硫酸溶液反应 | |
| C. | 夏天,块状的锌与2mol/L稀硫酸溶液反应 | |
| D. | 夏天,粉末状的锌与2mol/L稀硫酸溶液反应 |
| A. | 石油的产量 | B. | 乙烯的产量 | C. | 汽油的产量 | D. | 合成纤维的产量 |
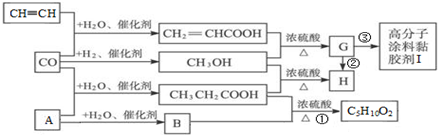
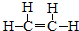 .
. CH3CH2COOC2H5+H2O,指出②的反应类型加成反应.
CH3CH2COOC2H5+H2O,指出②的反应类型加成反应.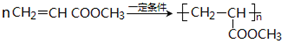 .
.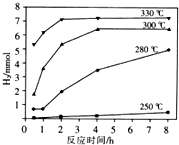 天然气的主要成分是甲烷,含有少量的羰基硫(COS)、乙硫醇(C2H5SH)等气体.
天然气的主要成分是甲烷,含有少量的羰基硫(COS)、乙硫醇(C2H5SH)等气体. .
.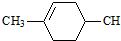 ═CHCOOCH2CH=CHCH2OOCH═
═CHCOOCH2CH=CHCH2OOCH═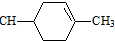
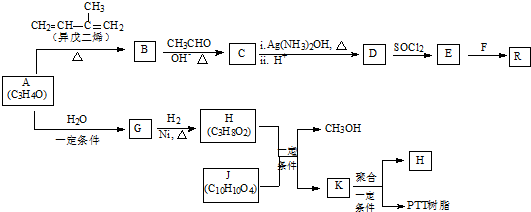
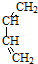 +
+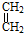 →
→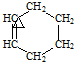
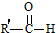 +
+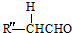 $→_{△}^{OH-}$R′CH
$→_{△}^{OH-}$R′CH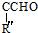 +H2O
+H2O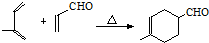 .
.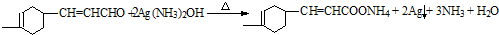 .
.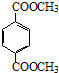 .
.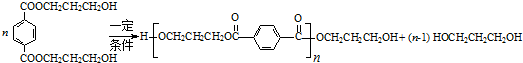 .
.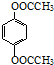 (邻、间、对三种中的任一种).
(邻、间、对三种中的任一种).