题目内容
10. 天然气的主要成分是甲烷,含有少量的羰基硫(COS)、乙硫醇(C2H5SH)等气体.
天然气的主要成分是甲烷,含有少量的羰基硫(COS)、乙硫醇(C2H5SH)等气体.(1)组成羰基硫的元素中,原子半径最小的元素在周期表中的位置是第二周期第VIA族.
(2)乙硫醇有特殊气味,是天然气的臭味指示剂.乙硫醇可以看作是乙醇分子中羟基(-OH)被-SH取代,则乙硫醇的结构式为
 .
.(3)下列事实可用于比较C与S两种元素非金属性(原子得电子能力)相对强弱的是d(填序号).
a.沸点:H2S>CH4 b.元素在周期表中的位置 c.酸性:H2SO3>H2CO3 d.同温同浓度水溶液的pH:Na2CO3>Na2SO4
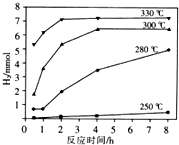
(4)羰基硫水解及利用的过程如下(部分产物已略去):COS$→_{Ⅰ}^{H_{2}O}$H2S$→_{Ⅱ}^{NaOH溶液}$Na2S溶液$→_{Ⅲ}^{△}$X溶液+H2
①常温下,在反应Ⅱ中,每吸收lgH2S气体放出热量a kJ,其热化学方程式为H2S(g)+2NaOH(aq)=Na2S(aq)+2H2O(l)△H=-34akJ/mol.
②已知X溶液中硫元素的主要存在形式为S2O32-,则反应Ⅲ中生成该离子的离子方程式为2S2-+5H2O=S2O32-+4H2↑+2OH-.
③如图是反应Ⅲ中,在不同反应温度下,反应时间与H2产量的关系图(Na2S初始含量为3mmo1).请结合图象数据解释X溶液中除S2O32-外,还有SO32-、SO42-的原因.答:从图形可知,$\frac{n({H}_{2})}{n(N{a}_{2}S)}$>2,故部分硫元素的化合价将高于+2价.
分析 (1)电子层数越多,原子半径越大,电子层数相同的,原子序数越大,半径越小;
(2)根据乙醇的结构式分析;
(3)比较非金属性强弱,可以通过氢化物的稳定性、单质的氧化性、最高价氧化物水化物的酸性等角度分析;
(4)①常温下,在反应Ⅱ中,每吸收lgH2S气体放出热量a kJ,然后求出34g硫化氢即1mol反应的热效应,然后写出其热化学方程式;
②硫化钠与水反应生成S2O32-、氢气和氢氧化钠,根据电子守恒和原子守恒书写;
③3molNa2S若只生成S2O32-转移12mol电子,根据电子守恒可知,生成的氢气为6mol,由图象可知,生成的氢气大于6mol,则Na2S失去的电子的物质的量大于12mol.
解答 解:(1)电子层数越多,原子半径越大,电子层数相同的,原子序数越大,半径越小,则原子半径:S>C>O,则O原子的半径最小,O元素位于第二周期第VIA族;
故答案为:第二周期第VIA族;
(2)乙硫醇可以看作是乙醇分子中羟基(-OH)被-SH取代,则乙硫醇的结构式为 ,故答案为:
,故答案为: ;
;
(3)a.氢化物的沸点高低与分子间作用力有关,不能根据沸点高低判断非金属性,故a错误;
b.根据周期表中位置可知非金属性:O>C,O>S,但是不能比较C与S,故b错误;
c.元素的非金属性越强,其最高价氧化物水化物的酸性越强,但是H2SO3不是最高价含氧酸,故c错误;
d.元素的非金属性越强,其最高价氧化物水化物的酸性越强,同温同浓度水溶液的pH:Na2CO3>Na2SO4,说明碳酸的酸性小于硫酸,则非金属性:C<S,故d正确;
故答案为:d;
(4)①常温下,在反应Ⅱ中,每吸收lgH2S气体放出热量a kJ,则34g硫化氢即1mol反应的热效应为34akJ,所以其热化学方程式为H2S(g)+2NaOH(aq)=Na2S(aq)+2H2O(l)△H=-34akJ/mol;
故答案为:H2S(g)+2NaOH(aq)=Na2S(aq)+2H2O(l)△H=-34akJ/mol;
②硫化钠与水反应生成S2O32-、氢气和氢氧化钠,其反应的离子方程式为:2S2-+5H2O=S2O32-+4H2↑+2OH-,故答案为:2S2-+5H2O=S2O32-+4H2↑+2OH-;
③3molNa2S若只生成S2O32-转移12mol电子,根据电子守恒可知,生成的氢气为6mol,即$\frac{n({H}_{2})}{n(N{a}_{2}S)}$=2,由图象可知,生成的氢气大于6mol,则$\frac{n({H}_{2})}{n(N{a}_{2}S)}$>2,所以Na2S失去的电子的物质的量大于12mol,因此产物中S的化合价高于+2价,所以有SO32-、SO42-;
故答案为:从图形可知,$\frac{n({H}_{2})}{n(N{a}_{2}S)}$>2,故部分硫元素的化合价将高于+2价.
点评 本题以硫的化合物的性质为知识背景,考查了原子半径的比较、有机物的结构式、元素非金属性判断、热化学方程式、氧化还原反应等,侧重于考查学生对基础知识的综合应用能力.

 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案X$\stackrel{O_{2}}{→}$酸性氧化物→酸.
| A. | X可能是Al单质 | B. | X可能是H2 | ||
| C. | 酸可能为H2SO4 | D. | 酸性氧化物可能为SiO2 |
| A. | 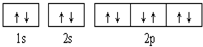 可表示单核10电子粒子基态时电子排布 可表示单核10电子粒子基态时电子排布 | |
| B. | 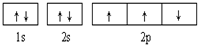 此图错误,违背了泡利原理 此图错误,违背了泡利原理 | |
| C. | 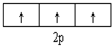 表示基态N原子的价电子排布 表示基态N原子的价电子排布 | |
| D. |  表示处于激发态的B的电子排布图 表示处于激发态的B的电子排布图 |
| A. | 一定温度下,10mL 0.50mol•L-1NH4Cl溶液与20mL 0.25mol•L-1NH4C1溶液含NH4+物质的量相同 | |
| B. | 25℃时,将a mo1•L-l氨水与0.01 moI•L-1盐酸等体积混合,反应完全时溶液中c(NH4+)=c(C1-),用含a的代数式表示反应完全时NH3•H2O的电离常数Kb=$\frac{1{0}^{-9}}{a-0.01}$ | |
| C. | 一定温度下,已知0.1 mol•L-1 的醋酸溶液中存在电离平衡:CH3COOH?CH3COO-+H+,加少量烧碱溶液可使溶液中$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$值增大 | |
| D. | 等体积、pH都为3的酸HA和HB分别与足量的锌反应,HA放出的氢气多,说明酸性:HA>HB |
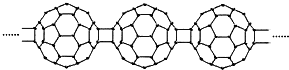
下列有关说法正确的是( )
| A. | C60转变为X是物理变化 | B. | X中含有极性共价键 | ||
| C. | X与金刚石互为同素异形体 | D. | X能够发生加成反应 |
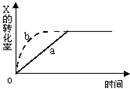 图中a曲线表示一定条件下可逆反应:X(g)+Y(g)?2Z(g)+W(s),△H<0的反应过程,若使 a曲线变为b曲线,可采用的措施是( )
图中a曲线表示一定条件下可逆反应:X(g)+Y(g)?2Z(g)+W(s),△H<0的反应过程,若使 a曲线变为b曲线,可采用的措施是( )| A. | 增大体积 | B. | 增大Y的浓度 | C. | 缩小体积 | D. | 降低温度 |
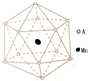 准晶体亦称为准晶或拟晶,是一种介于晶体和非晶体之间的固体结构.
准晶体亦称为准晶或拟晶,是一种介于晶体和非晶体之间的固体结构. ,与B的离子具有相同电子数的微粒中,有一种分子可与盐酸化合生成一种盐,该反应的化学方程式是NH3+HCl═NH4Cl;
,与B的离子具有相同电子数的微粒中,有一种分子可与盐酸化合生成一种盐,该反应的化学方程式是NH3+HCl═NH4Cl; ,周期表中与C上下相邻的同主族元素形成的气态氢化物中,稳定性最强的是HF(填氢化物化学式).
,周期表中与C上下相邻的同主族元素形成的气态氢化物中,稳定性最强的是HF(填氢化物化学式).
 .
.