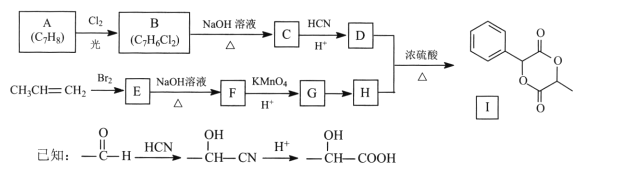
题目内容
【题目】氟代硼酸钾(KBe2BO3F2)是激光器的核心材料,我国化学家在此领域的研究走在了世界的最前列。回答下列问题:
(1)氟代硼酸钾中各元素原子的第一电离能大小顺序是F>O>____________。基态K+电子占据最高能级的电子云轮廓图为________形。
(2)NaBH4是有机合成中常用的还原剂,其中的阴离子空间构型是_______,中心原子的杂化形式为_______。NaBH4中存在_____(填标号)。
a. 离子键 b.氢键 c.σ键 d.π键
(3)BeCl2中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的BeCl2的结构式为________,其中Be的配位数为_______。
(4)第三周期元素氟化物的熔点如下表:
化合物 | NaF | MgF2 | AlF3 | SiF4 | PF5 | SF6 |
熔点/℃ | 993 | 1261 | 1291 | -90 | -83 | -50.5 |
解释表中氟化物熔点变化的原因:_____________________。
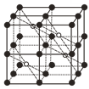
(5)CaF2的一种晶胞如图所示。Ca2+占据F-形成的空隙,其空隙率是________。若r(F-)=xpm,r(Ca2+)=ypm,设阿伏加德罗常数的值为NA,则CaF2的密度ρ=_________ g·cm-3(列出计算表达式)。
【答案】Be>B>K 哑铃 正四面体 sp3 ac ![]() 3 前三种为离子晶体,晶格能依次增大,后三种为分子晶体,分子间力依次增大。 50%
3 前三种为离子晶体,晶格能依次增大,后三种为分子晶体,分子间力依次增大。 50% 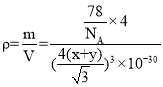
【解析】
⑴第一电离能从左到右增大,但第IIA大于第IIIA,第VA大于第VIA,从上到下递减;p能级,其电子云轮廓图为哑铃形。
⑵BH4-阴离子有4个σ键,因此中心原子的杂化形式为sp3,其空间构型是正四面体,Na+与BH4-形成离子键,BH4-内部有共价键和σ键。
⑶BeCl2中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的BeCl2的结构式为![]() ,根据Be原子的周围连接的氯原子得Be的配位数为3。
,根据Be原子的周围连接的氯原子得Be的配位数为3。
⑷氟化物熔点变化的原因:前三种为离子晶体,晶格能依次增大,后三种为分子晶体,分子间力依次增大。
⑸根据结构看出氟离子在顶点、棱心、面心、体内,总共8个氟离子,F-形成的空隙有八个,而Ca2+占据了其中的四个,还有四个空隙是空的,因此空隙率是50%,若r(F-)=x pm,r(Ca2+)=y pm,根据图中得出体对角线为4 [r(F-)+ r(Ca2+)],晶胞中总共有4个钙离子,8个氟离子,根据密度公式进行计算。
⑴第一电离能从左到右增大,但第IIA大于第IIIA,第VA大于第VIA,从上到下递减,氟代硼酸钾中各元素原子的第一电离能大小顺序是F>O>Be>B>K,基态K+电子占据最高能级为p能级,其电子云轮廓图为哑铃形,故答案为:>Be>B>K;哑铃。
⑵BH4-阴离子有4个σ键,因此中心原子的杂化形式为sp3,其空间构型是正四面体,Na+与BH4-形成离子键,BH4-内部有共价键和σ键,因此NaBH4中存在ac,故答案为:正四面体;sp3;ac。
⑶BeCl2中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的BeCl2的结构式为![]() ,根据Be原子的周围连接的氯原子得Be的配位数为3,故答案为:
,根据Be原子的周围连接的氯原子得Be的配位数为3,故答案为:![]() ;3。
;3。
⑷氟化物熔点变化的原因:前三种为离子晶体,晶格能依次增大,后三种为分子晶体,分子间力依次增大,故答案为:前三种为离子晶体,晶格能依次增大,后三种为分子晶体,分子间力依次增大。
⑸根据结构看出氟离子在顶点、棱心、面心、体内,总共8个氟离子,F-形成的空隙有八个,而Ca2+占据了其中的四个,还有四个空隙是空的,因此空隙率是50%,若r(F-)=x pm,r(Ca2+)=y pm,根据图中得出体对角线为4 [r(F-)+ r(Ca2+)],晶胞中总共有4个钙离子,8个氟离子,因此CaF2的密度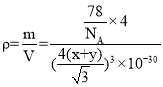 g·cm-3,故答案为:
g·cm-3,故答案为: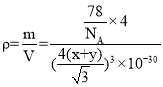 。
。

 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案