题目内容
9.与氢氧根离子(OH-)具有相同的质子数和电子数的微粒是( )| A. | CH4 | B. | NH4+ | C. | NH2- | D. | Cl- |
分析 氢氧根离子中质子数为各元素的质子数之和,一个氢氧根离子中的质子数是9个,电子数是10个.
解答 解:氢氧根离子中质子数为各元素的质子数之和,一个氢氧根离子中的质子数是9个,电子数是10个.
A.甲烷分子中质子数是10,电子数是10,所以和氢氧根离子中质子数相同,电子数不同,故A错误;
B.铵根离子中质子数是11,电子数是10,所以和氢氧根离子中质子数不同,电子数相同,故B错误;
C.NH2-中质子数是9,电子数是10,所以和氢氧根离子中质子数和电子数都相同,故C正确;
D.氯离子中质子数是17,电子数是18,所以和氢氧根离子中质子数和电子数都不同,故D错误.
故选C.
点评 本题考查了离子中质子数和电子数的计算,难度不大,明确阳离子中质子数=电子数+电荷数,阴离子中质子数=电子数-电荷数.

练习册系列答案
相关题目
19.能够鉴定溴乙烷中溴元素的存在的操作是( )
| A. | 在溴乙烷中直接加入AgNO3溶液 | |
| B. | 在溴乙烷中加蒸馏水,然后加入AgNO3溶液 | |
| C. | 在溴乙烷中加入NaOH溶液,加热后酸化,然后加入AgNO3溶液 | |
| D. | 在溴乙烷中加入乙醇加热后,然后加入AgNO3溶液 |
20.下列对实验现象或操作的解释不合理的是( )
| 操作及现象 | 解释 | |
| A | 鸡蛋白溶液中分别加入NaCl溶液和HgCl2溶液,均有固体析出 | 蛋白质发生了变性 |
| B | 盛放浓NaOH溶液的试剂瓶用玻璃塞久置后,瓶塞很难打开 | NaOH腐蚀玻璃,生成的硅酸钠将瓶口与瓶塞粘在一起 |
| C | 配制FeCl3溶液时加入适量盐酸酸化 | 抑制Fe3+水解,防止所配制溶液变浑浊 |
| D | 二氧化硫通入溴水,溴水褪色 | 说明二氧化硫具有还原性 |
| A. | A | B. | B | C. | C | D. | D |
4.化合物丙由如下反应得到:
C4H10O $\stackrel{H_{2}SO_{4}(浓),△}{→}$C4H8$→_{溶剂CCl_{4}}^{Br_{2}}$C4H8Br2(丙),丙的结构简式不可能是( )
C4H10O $\stackrel{H_{2}SO_{4}(浓),△}{→}$C4H8$→_{溶剂CCl_{4}}^{Br_{2}}$C4H8Br2(丙),丙的结构简式不可能是( )
| A. | CH3CH2CHBrCH2Br | B. | CH3CH(CH2Br)2 | C. | CH3CHBrCHBrCH3 | D. | (CH3)2CBrCH2Br |
14.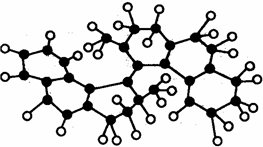 世界上最小的“马达”,只有千万分之一个蚊子那么大,其球棍模型如图(其中小黑球代表碳原子,小白球代表氢原子),它仅有碳氢两种元素组成,将来可用于消除体内垃圾. 该“马达”可能具有的性质是( )
世界上最小的“马达”,只有千万分之一个蚊子那么大,其球棍模型如图(其中小黑球代表碳原子,小白球代表氢原子),它仅有碳氢两种元素组成,将来可用于消除体内垃圾. 该“马达”可能具有的性质是( )
 世界上最小的“马达”,只有千万分之一个蚊子那么大,其球棍模型如图(其中小黑球代表碳原子,小白球代表氢原子),它仅有碳氢两种元素组成,将来可用于消除体内垃圾. 该“马达”可能具有的性质是( )
世界上最小的“马达”,只有千万分之一个蚊子那么大,其球棍模型如图(其中小黑球代表碳原子,小白球代表氢原子),它仅有碳氢两种元素组成,将来可用于消除体内垃圾. 该“马达”可能具有的性质是( )| A. | 溶于水 | B. | 可以燃烧 | ||
| C. | 能和溴水发生取代反应 | D. | 能发生消去反应 |
18.元素周期表中某区域的一些元素多用于制造半导体材料,它们是( )
| A. | 稀有气体元素 | |
| B. | 左、下方区域的金属元素 | |
| C. | 右、上方区域的非金属元素 | |
| D. | 金属元素和非金属元素分界线附近的元素 |
19.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 1.0 mol•L-1的KNO3溶液:H+、Fe2+、Cl-、SO42- | |
| B. | 甲基橙呈红色的溶液:NH4+、Ba2+、AlO2-、Cl- | |
| C. | 与铝反应产生大量氢气的溶液:Na+、K+、CO32-、Cl- | |
| D. | pH=12的溶液:K+、Na+、CH3COO-、Br- |
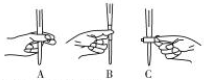
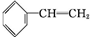 +Br2
+Br2
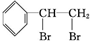 .
.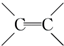 $\stackrel{稀,冷KMnO_{4},溶液/OH-}{→}$
$\stackrel{稀,冷KMnO_{4},溶液/OH-}{→}$ .请写出A与稀、冷的KMnO4溶液在碱性条件下反应的化学方程式
.请写出A与稀、冷的KMnO4溶液在碱性条件下反应的化学方程式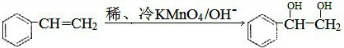 .
. .
.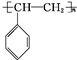 .
.