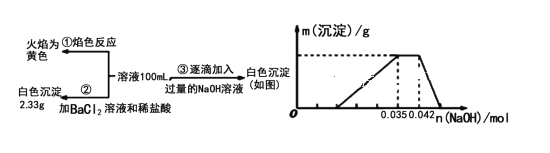
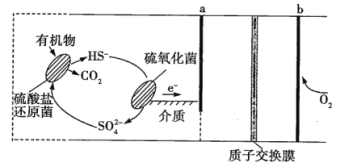
题目内容
【题目】根据下列实验装置图回答问题:
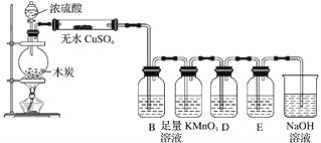
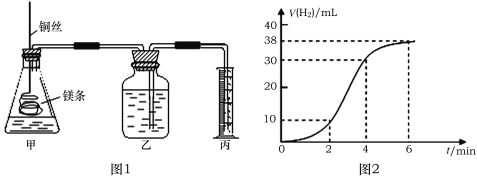
(1)浓H2SO4和木炭在加热时发生反应的化学方程式是__,如果有0.2mol电子转移,则在标准状况下产生气体__。
(2)若用图示中的装置检验上述反应的全部产物,写出有关仪器中应加入的试剂和作用:无水CuSO4试剂作用是__,B中加入的试剂是__,作用是__,足量KMnO4溶液作用是___,D中加入的试剂是__,作用是__,NaOH溶液的作用是__。
【答案】C+2H2SO4(浓)![]() 2H2O+CO2↑+2SO2↑ 3.36L 检验水 品红或高锰酸钾或溴水 检验二氧化硫 除去二氧化硫 澄清石灰水 检验二氧化碳 吸收多余的二氧化硫,防止污染环境
2H2O+CO2↑+2SO2↑ 3.36L 检验水 品红或高锰酸钾或溴水 检验二氧化硫 除去二氧化硫 澄清石灰水 检验二氧化碳 吸收多余的二氧化硫,防止污染环境
【解析】
(1)木炭粉与浓硫酸发生反应产生SO2和CO2气体;根据碳由0价升高为+4价,生成1个CO2↑转移4个电子,然后求出CO2和SO2的体积;
(2)根据实验目的和装置图考虑操作步骤和试剂的作用及发生反应。从整体考虑,无水CuSO4的作用是检验水,B为检验二氧化硫装置,足量KMnO4溶液作用是除去二氧化硫,最后为检验二氧化碳的装置;
(1)木炭粉与浓硫酸发生反应产生SO2和CO2气体,反应的方程式为:C+2H2SO4(浓)![]() 2H2O+CO2↑+2SO2↑,碳由0价升高为+4价,生成1个CO2转移4个电子,如果有0.2mol电子转移,则在标准状况下产生0.05molCO2和0.1molSO2,气体的体积为0.15mol×22.4L/mol=3.36L;
2H2O+CO2↑+2SO2↑,碳由0价升高为+4价,生成1个CO2转移4个电子,如果有0.2mol电子转移,则在标准状况下产生0.05molCO2和0.1molSO2,气体的体积为0.15mol×22.4L/mol=3.36L;
(2)反应生成水,可使无水CuSO4变蓝,故无水CuSO4试剂作用是:检验水;SO2具有还原性,可与高锰酸钾或溴水发生氧化还原反应,溶液褪色,SO2具有漂白性,能使品红褪色,故B中加入的试剂是:品红或高锰酸钾溶液或溴水,其作用是检验SO2;由于SO2的存在干扰CO2的检验,故利用SO2具有还原性,可与酸性高锰酸钾发生氧化还原反应,用足量的KMnO4溶液将SO2完全除去;产物中有CO2,用澄清的石灰水检验CO2,故D中加入的试剂是澄清石灰水,用于检验产物CO2;最后NaOH溶液的作用是:吸收多余的SO2,防止污染环境。

 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案【题目】某实验小组制备草酸晶体(H2C2O4·2H2O)的实验装置如下:
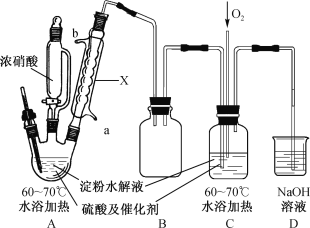
已知:I.草酸(H2C2O4)是二元弱酸,熔点101~102℃;
II.草酸的溶解度如下表所示:
温度/℃ | 20 | 30 | 40 | 50 | 60 | 70 |
溶解度/g·(100g水)-1 | 9.5 | 14.3 | 21.2 | 31.4 | 46.0 | 84.5 |
III.在催化剂和硫酸存在下,用浓硝酸氧化淀粉水解液可制备草酸,发生的主要反应为:
C6H12O6+12HNO3→3H2C2O4+9NO2↑+3NO↑+9H2O。
回答下列问题:
(1)装置A中仪器X名称为___________,水从接口___________(填“a”或“b”)进入。
(2)装置B的作用是___________;设计装置C的目的是_________________________。
(3)反应C6H12O6+12HNO3→3H2C2O4+9NO2↑+3NO↑+9H2O中,每生成1 mol H2C2O4转移电子的物质的量为____________。
(4)将装置A和C中反应液浓缩、静置结晶并过滤得粗草酸晶体,提纯H2C2O4·2H2O的方法是_________________________。
(5)探究草酸的性质:
①向Na2CO3溶液中滴加H2C2O4溶液,产生大量气体,说明草酸的酸性比碳酸________(填“强”或“弱”)。
②向NaClO溶液中加入过量H2C2O4溶液,有气泡产生,能解释这一现象的离子方程式为___。