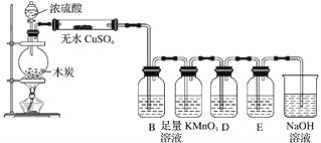
题目内容
【题目】用质量分数为36.5%的浓盐酸(密度为1.16 g·cm-3)配制成1 mol·L-1的稀盐酸。现实验室仅需要这种盐酸220 mL,试回答下列问题:
(1)经计算需要________mL浓盐酸。
(2)在配制稀盐酸溶液时,选用的仪器除了玻璃棒、烧杯、胶头滴管、还有______________。
(3)在量取浓盐酸后,进行了下列操作:
①等稀释的盐酸的温度与室温一致后,沿玻璃棒注入250 mL容量瓶中。
②往容量瓶中小心加蒸馏水至液面离容量瓶刻度线1~2 cm时,改用胶头滴管加蒸馏水,使溶液的液面最低处与瓶颈的刻度标线相切。
③在盛盐酸的烧杯中注入蒸馏水,并用玻璃棒搅动,使其混合均匀。
④用蒸馏水洗涤烧杯和玻璃棒2~3次,并将洗涤液全部注入容量瓶。
上述操作中,正确的顺序是(填序号)___________________________。
(4)在上述配制过程中,用刚刚洗涤洁净的量筒来量取浓盐酸,其配制的稀盐酸浓度________(填“偏高”“偏低”或“无影响”)。若未用蒸馏水洗涤烧杯内壁或未将洗涤液注入容量瓶,则配制的稀盐酸浓度______(填“偏高”“偏低”或“无影响”)。
【答案】21.6mL 量筒、250mL容量瓶 ③①④② 偏低 偏低
【解析】
(1)先依据![]() 计算浓盐酸的物质的量浓度,再依据溶液稀释过程中所含溶质的物质的量不变计算需要浓盐酸的体积;
计算浓盐酸的物质的量浓度,再依据溶液稀释过程中所含溶质的物质的量不变计算需要浓盐酸的体积;
(2)依据配制一定物质的量浓度溶液的操作步骤选择需要的仪器;
(3)依据配制一定物质的量浓度溶液的操作步骤排序;
(4)分析操作对溶质的物质的量和溶液的体积的影响,依据![]() 进行误差分析。
进行误差分析。
(1)质量分数为36.5%的盐酸(密度为1.16gcm3)的物质的量浓度![]() ,已知需配制1 mol·L-1的稀盐酸220 mL,需要用250mL容量瓶,则配制稀盐酸的体积为250mL,设需要浓盐酸体积为V,则依据溶液稀释过程中所含溶质的物质的量不变得,V×11.6mol/L=1mol/L×0.25L,解得,V=21.6mL;
,已知需配制1 mol·L-1的稀盐酸220 mL,需要用250mL容量瓶,则配制稀盐酸的体积为250mL,设需要浓盐酸体积为V,则依据溶液稀释过程中所含溶质的物质的量不变得,V×11.6mol/L=1mol/L×0.25L,解得,V=21.6mL;
故答案为:21.6;
(2)配制1molL1的稀盐酸220mL,应选择250mL容量瓶,用浓溶液配制一定物质的量浓度稀溶液的操作步骤为:计算、量取、稀释、冷却、移液、洗涤、定容等,用到的仪器:量筒、烧瓶、玻璃棒、250mL容量瓶、胶头滴管,所以还需要的是:量筒、250mL容量瓶;
故答案为:量筒、250mL容量瓶;
(3)用浓溶液配制一定物质的量浓度稀溶液的操作步骤为:计算、量取、稀释、冷却、移液、洗涤、定容、摇匀等,所以正确的操作顺序为:③①④②;
故答案为:③①④②;
(4)用刚刚洗涤洁净的量筒来量取浓盐酸,导致浓盐酸被稀释,量取的盐酸中含有氯化氢物质的量偏小,溶液浓度偏低;若未用蒸馏水洗涤烧杯内壁或未将洗涤液注入容量瓶,导致溶质的物的量偏小,溶液浓度偏低;
故答案为:偏低;偏低。

 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案