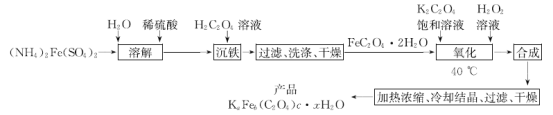
题目内容
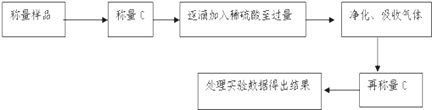
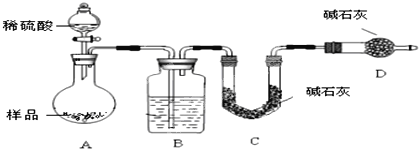
【题目】某同学在探究废干电池内的黑色固体回收利用时,进行下图所示实验:
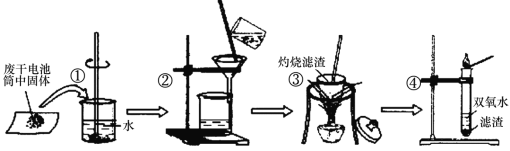
查阅教材可知,普通锌锰电池的黑色物质主要成分为MnO2、NH4Cl、ZnCl2等物质。请回答以下问题:
(1)锌锰电池的负极材料是________。
(2)操作③灼烧滤渣时所用主要仪器有酒精灯、玻璃棒、______、泥三角和三脚架;灼烧滤渣时,产生一种无色无味能使澄清石灰水变浑浊的气体,由此推测灼烧前的滤渣中存在的物质有___________。
(3)往操作④的试管中加入操作③灼烧后所得黑色固体,试管中迅速产生能使带火星的木条复燃的气体,据此可初步认定灼烧后的黑色固体为_________, 操作④相关的化学方程式为_______________。
(4)该同学要对滤液的成分进行检验,以确认是否含有NH4+,该同学取少许滤液于试管中__________________(填写操作与现象),则证实滤液中含有NH4+。
(5)该同学利用在废旧干电池中回收的Zn片和石墨电极,设计一个原电池实验,比较铜与锌的金属活动性强弱。
限用材料:铜片、锌片、石墨电极、稀硫酸、CuSO4溶液、ZnSO4溶液;
限用仪器:直流电源、电流计、导线、烧杯、试管、盐桥等中学化学常见的药品和仪器请画出实验装置图,标出电极材料、电解质溶液_________________。
【答案】锌(Zn) 坩埚 C(碳) 二氧化锰(MnO2) 2H2O2 ![]() 2H2O+O2↑ 加入浓氢氧化钠溶液并加热,将润湿的红色石蕊试纸置于试管口附近,试纸变蓝色
2H2O+O2↑ 加入浓氢氧化钠溶液并加热,将润湿的红色石蕊试纸置于试管口附近,试纸变蓝色 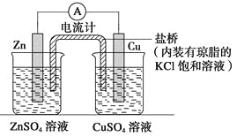
【解析】
(1)Zn为活泼金属,失去电子;
(2)操作③灼烧需要在坩埚中进行,无色无味能使澄清石灰水变浑浊的气体为二氧化碳;
(3)操作④的试管中加入操作③灼烧后所得黑色固体,试管中迅速产生能使带火星的木条复燃的气体,气体为氧气,可知灼烧后的黑色固体为二氧化锰;
(4)铵根离子与碱反应生成氨气,氨气可使湿润的红色石蕊试纸变蓝;
(5)设计一个原电池实验,比较铜与锌的金属活动性强弱,可选Zn为负极、Cu为正极,选硫酸锌、硫酸铜作电解质,利用盐桥、导线形成闭合回路;
(1)锌锰电池的负极材料是锌(Zn),失去电子被氧化;
答案为:锌(Zn);
(2)操作③灼烧滤渣时所用主要仪器有酒精灯、玻璃棒、坩埚、泥三角和三脚架;灼烧滤渣时,产生一种无色无味能使澄清石灰水变浑浊的气体,由此推测灼烧前的滤渣中存在的物质有C(碳);
答案为:坩埚;C(碳);
(3)往操作④的试管中加入操作③灼烧后所得黑色固体,试管中迅速产生能使带火星的木条复燃的气体,据此可初步认定灼烧后的黑色固体为二氧化锰(MnO2),操作④相关的化学方程式为![]() ;
;
答案为:二氧化锰(MnO2);![]() ;
;
(4)确认是否含有NH4+,该同学取少许滤液于试管中加入浓氢氧化钠溶液并加热,将润湿的红色石蕊试纸置于试管口附近,试纸变蓝色,则证实滤液中含有NH4+;
答案为:加入浓氢氧化钠溶液并加热,将润湿的红色石蕊试纸置于试管口附近,试纸变蓝色;
(5)设计一个原电池实验,比较铜与锌的金属活动性强弱,可选Zn为负极、Cu为正极,选硫酸锌、硫酸铜作电解质,利用盐桥、导线形成闭合回路,则原电池装置图为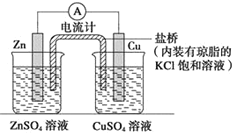 ;
;
答案为: 。
。