题目内容
13.将一定量有机物充分燃烧后的产物通入足量石灰水中完全吸收,经过滤得到沉淀18.00g,滤液质量比石灰水减少5.22g,该有机物可能是( )| A. | 乙烯 | B. | 乙二醇(HO-CH2-CH2-OH) | ||
| C. | 丙烷 | D. | 甲酸甲酯(HCOOCH3) |
分析 有机物燃烧充分燃烧生成CO2和H2O,产物通过足量的石灰水,发生反应:CO2+Ca(OH)2=CaCO3↓+H2O,得到沉淀18.00g为CaCO3质量,根据差量法计算生成碳酸钙的反应中导致溶液质量减少,再结合实际滤液质量减少计算燃烧生成水的质量,确定C、H原子数目之比,据此判断.
解答 解:有机物燃烧产物有二氧化碳和水,将燃烧产物通过足量的石灰水,经过滤可得沉淀18.00g,应为CaCO3,n(CO2)=n(CaCO3)=$\frac{18.00g}{100g/mol}$=0.18mol,
CO2+Ca(OH)2=CaCO3↓+H2O 滤液减少的质量56
1mol 100g 56g
0.18mol 18g $\frac{56g×0.18mol}{1mol}$=10.08g
称量滤液时,其质量只比原石灰水减少5.22g,则生成水的质量应为10.08g-5.22g=4.84g,
则n(H)=2n(H2O)=$\frac{4.86g}{18g/mol}$×2=0.54mol,
则有机物中N(C):N(H)=0.18mol:0.54mol=1:3,
选项中乙二醇中C、H原子数目之比符合1:3,而乙烯、丙烷、甲酸甲酯不符合,
故选B.
点评 本题考查有机物推断,难度中等,关键是结合差量法计算生成水的质量,侧重考查学生的分析计算能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
8.下表是三种食品包装上的部分说明.
上表所列配料中,富含淀粉的是⑨(填序号,下同),富含油脂的是⑭,富含蛋白质的是⑤⑩⑫,富含维生素的是①⑪,属于调味剂的是②⑥⑦,属于着色剂的是③⑬,属于防腐剂的是④⑧.
| 品名 | 部分配料 |
| 菠萝汁 | ①浓缩菠萝汁 ②白砂糖 ③柠檬黄 ④山梨酸钾 |
| 火腿肠 | ⑤精选瘦肉 ⑥食盐 ⑦味精 ⑧亚硝酸钠 |
| 方便面 | ⑨小麦粉 ⑩牛肉⑪脱水菠菜⑫鸡蛋⑬姜黄⑭食用棕榈油 |
18.对可逆反应2SO2+O2?2SO3,下列叙述正确的是( )
| A. | 达平衡时若两种反应物的转化率相等,则起始投入的n(SO2):n(O2)=2:1 | |
| B. | 反应达到平衡后,缩小容器体积,正反应速率加快,逆反应速率减慢,平衡正向移动 | |
| C. | 反应达到平衡后,再加人催化剂.平衡不移动,反应速率不变 | |
| D. | 当v正(SO2):v正(SO3)=1:1时.说明该反应已经达到平衡 |
2.如表为元素周期表的一部分,已列出10种元素在周期表中的位置.按要求回答下列问题.
(1)10种元素中,金属性最强的是(填元素符号,下同)K,化学性质最不活泼的是Ar.
(2)过量的①的最高价氧化物对应的水化物和⑤的最高价氧化物对应的水化物反应的离子方程式为OH-+Al(OH)3=AlO2-+2H2O.
(3)等电子的①③⑤⑦四种元素形成的离子,离子半径由大到小的顺序是(填离子符号)O2->Na+>Mg2+>Al3+.
(4)⑥、⑦、⑧元素形成的氢化物中,沸点最高的是H2O,理由是水分子中存在氢键常温下水为液态,其它氢化物分子中无氢键,常温下为气态.
(5)⑨的最高价氧化物对应的水化物的化学式为HBrO4,从浓缩海水中提取元素⑨单质的离子方程式为Cl2+2Br-=2Cl-+Br2.
(6)上述元素中:形成的既含有离子键、又含有极性共价键的难溶于水的化合物化学式为CaCO3,形成的既含有非极性共价键、又含有离子键的化合物有Na2O2.
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 第2周期 | ⑥ | ⑦ | ||||||
| 第3周期 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 第4周期 | ② | ④ | ⑨ |
(2)过量的①的最高价氧化物对应的水化物和⑤的最高价氧化物对应的水化物反应的离子方程式为OH-+Al(OH)3=AlO2-+2H2O.
(3)等电子的①③⑤⑦四种元素形成的离子,离子半径由大到小的顺序是(填离子符号)O2->Na+>Mg2+>Al3+.
(4)⑥、⑦、⑧元素形成的氢化物中,沸点最高的是H2O,理由是水分子中存在氢键常温下水为液态,其它氢化物分子中无氢键,常温下为气态.
(5)⑨的最高价氧化物对应的水化物的化学式为HBrO4,从浓缩海水中提取元素⑨单质的离子方程式为Cl2+2Br-=2Cl-+Br2.
(6)上述元素中:形成的既含有离子键、又含有极性共价键的难溶于水的化合物化学式为CaCO3,形成的既含有非极性共价键、又含有离子键的化合物有Na2O2.
3.向CR3COONa稀溶液中加入(或通入)少许X物质,其溶液中部分微粒浓度变化如表所示(溶液温度不变),则X可能为:( )
| 微粒 | H+ | OH- | CH3COO- | CH3COOH |
| 物质的量浓度 | 增大 | 减小 | 减小 | 增大 |
| A. | 氢氧化钠 | B. | 氯化氢 | C. | 蒸馏水 | D. | CH3COOH |
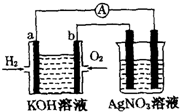 化学在能源开发与利用中起着十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.
化学在能源开发与利用中起着十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.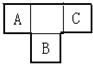 A、B、C为短周期元素,在周期表的位置如图所示.A、C两元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等.
A、B、C为短周期元素,在周期表的位置如图所示.A、C两元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等.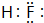 .
.