题目内容
2.如表为元素周期表的一部分,已列出10种元素在周期表中的位置.按要求回答下列问题.| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 第2周期 | ⑥ | ⑦ | ||||||
| 第3周期 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 第4周期 | ② | ④ | ⑨ |
(2)过量的①的最高价氧化物对应的水化物和⑤的最高价氧化物对应的水化物反应的离子方程式为OH-+Al(OH)3=AlO2-+2H2O.
(3)等电子的①③⑤⑦四种元素形成的离子,离子半径由大到小的顺序是(填离子符号)O2->Na+>Mg2+>Al3+.
(4)⑥、⑦、⑧元素形成的氢化物中,沸点最高的是H2O,理由是水分子中存在氢键常温下水为液态,其它氢化物分子中无氢键,常温下为气态.
(5)⑨的最高价氧化物对应的水化物的化学式为HBrO4,从浓缩海水中提取元素⑨单质的离子方程式为Cl2+2Br-=2Cl-+Br2.
(6)上述元素中:形成的既含有离子键、又含有极性共价键的难溶于水的化合物化学式为CaCO3,形成的既含有非极性共价键、又含有离子键的化合物有Na2O2.
分析 由元素在周期表中位置,可知①为Na、②为K、③为Mg、④为Ca、⑤为Al、⑥为C、⑦为O、⑧为Cl、⑨为Br、⑩为Ar.
(1)同周期自左而右金属性减弱,同主族自上而下金属性增强;稀有气体原子最外层为稳定结构,化学性质最不活泼;
(2)①、⑤的最高价氧化物对应的水化物分别为NaOH、Al(OH)3,二者反应生成偏铝酸钠与水;
(3)电子层结构相同的离子,核电荷数越大离子半径越小;
(4)水分子之间存在氢键沸点最高,其它氢化物分子间不能形成氢键;
(5)⑨的最高价氧化物对应的水化物为高溴酸,用氯气将海水中溴离子氧化为溴单质提取元素溴;
(6)上述元素中:形成的既含有离子键、又含有极性共价键的难溶于水的化合物为碳酸钙,形成的既含有非极性共价键、又含有离子键的化合物有过氧化钠.
解答 解:由元素在周期表中位置,可知①为Na、②为K、③为Mg、④为Ca、⑤为Al、⑥为C、⑦为O、⑧为Cl、⑨为Br、⑩为Ar.
(1)同周期自左而右金属性减弱,同主族自上而下金属性增强,故上述元素中K的金属性最强;稀有气体Ar原子最外层为稳定结构,化学性质最不活泼,
故答案为:K;Ar;
(2)①、⑤的最高价氧化物对应的水化物分别为NaOH、Al(OH)3,二者反应生成偏铝酸钠与水,反应离子方程式为:OH-+Al(OH)3=AlO2-+2H2O,
故答案为:OH-+Al(OH)3=AlO2-+2H2O;
(3)电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径:O2->Na+>Mg2+>Al3+,
故答案为:O2-;Na+;Mg2+;Al3+;
(4)水分子中存在氢键常温下水为液态,其它氢化物分子中无氢键,常温下为气态,故水的沸点最高,
故答案为:H2O;水分子中存在氢键常温下水为液态,其它氢化物分子中无氢键,常温下为气态;
(5)⑨的最高价氧化物对应的水化物为HBrO4,用氯气将海水中溴离子氧化为溴单质提取元素溴,反应离子方程式为:Cl2+2Br-=2Cl-+Br2,
故答案为:HBrO4;Cl2+2Br-=2Cl-+Br2;
(6)上述元素中:形成的既含有离子键、又含有极性共价键的难溶于水的化合物为CaCO3,形成的既含有非极性共价键、又含有离子键的化合物有Na2O2,
故答案为:CaCO3;Na2O2.
点评 本题考查元素周期表与元素周期律,难度不大,注意整体把握元素周期表的结构,理解掌握元素周期律.

 全优点练单元计划系列答案
全优点练单元计划系列答案| A. | 乙烯 | B. | 乙二醇(HO-CH2-CH2-OH) | ||
| C. | 丙烷 | D. | 甲酸甲酯(HCOOCH3) |
| A. | CO2通入澄清石灰水中 | B. | Na2CO3溶液中滴入HCl溶液 | ||
| C. | 硫酸中加入锌粉 | D. | 铁丝在氯气中燃烧 |
| A. | 硫酸、纯碱、硫酸钙 | B. | 盐酸、苛性钠、硫酸亚铁 | ||
| C. | 碳酸、乙醇、烧碱 | D. | 磷酸、熟石灰、生石灰 |
| A. | 氯化钠和水 | B. | 苯和甲苯 | C. | 苯甲酸和氯化钠 | D. | 四氯化碳和水 |
| A. | 紫色石蕊试液 | B. | 浓溴水 | C. | 新制Cu(OH)2悬浊液 | D. | FeCl3溶液 |
| A. | 1:4 | B. | 1:5 | C. | 2:1 | D. | 2:3 |
 乙烯苯甲酸结构如图:
乙烯苯甲酸结构如图: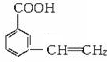 ,
,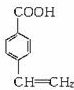 .
.