题目内容
5.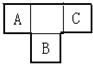 A、B、C为短周期元素,在周期表的位置如图所示.A、C两元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等.
A、B、C为短周期元素,在周期表的位置如图所示.A、C两元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等.(1)B元素位于元素周期表中第三周期,第VIA族.
(2)C的氢化物的电子式
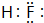 .
.(3)C单质通入水中反应的化学方程式为2F2+2H2O=4HF+O2.
分析 A、B、C为短周期元素,由它们在周期表中的位置,可知A、C处于第二周期,B处于第三周期,令A原子核外电子为x,则B质子数为x+9,C核外电子数为x+2,则:x+x+2=x+9,解得x=7,故A为N元素、B为S元素、C为F元素,据此解答.
解答 解:A、B、C为短周期元素,由它们在周期表中的位置,可知A、C处于第二周期,B处于第三周期,令A原子核外电子为x,则B质子数为x+9,C核外电子数为x+2,则:x+x+2=x+9,解得x=7,故A为N元素、B为S元素、C为F元素.
(1)由上述分析可知,B为S元素,处于第三周期VIA族,故答案为:三;VIA;
(2)C为F元素,其氢化物为HF,电子式为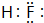 ,故答案为:
,故答案为: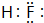 ;
;
(3)氟气与水反应生成HF与氧气,反应的化学方程式为:2F2+2H2O=4HF+O2,
故答案为:2F2+2H2O=4HF+O2.
点评 本题考查原子结构与元素周期表,难度不大,推断元素是解题关键,注意理解同主族元素原子序数关系.

练习册系列答案
相关题目
16.下列推论正确的是( )
| A. | S(g)+O2(g)═SO2(g)△H1,S(s)+O2(g)═SO2(g)△H2;则:△H1>△H2 | |
| B. | 需要加热才能发生的反应一定是吸热反应 | |
| C. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.4kJ/mol,则含20gNaOH的溶液与稀盐酸完全反应,放出的热量为28.7kJ | |
| D. | CaCO3(s)═CaO(s)+CO2(g)△H>0,△S>0,则:该反应任何温度下都能自发进行 |
13.将一定量有机物充分燃烧后的产物通入足量石灰水中完全吸收,经过滤得到沉淀18.00g,滤液质量比石灰水减少5.22g,该有机物可能是( )
| A. | 乙烯 | B. | 乙二醇(HO-CH2-CH2-OH) | ||
| C. | 丙烷 | D. | 甲酸甲酯(HCOOCH3) |
10.下列反应中,调节反应物用量或浓度不会改变反应产物的是( )
| A. | CO2通入澄清石灰水中 | B. | Na2CO3溶液中滴入HCl溶液 | ||
| C. | 硫酸中加入锌粉 | D. | 铁丝在氯气中燃烧 |
17.将下列物质按酸、碱、盐分类排列,正确的是( )
| A. | 硫酸、纯碱、硫酸钙 | B. | 盐酸、苛性钠、硫酸亚铁 | ||
| C. | 碳酸、乙醇、烧碱 | D. | 磷酸、熟石灰、生石灰 |
14.下列可用于鉴别乙醇、乙酸和乙醛的试剂是( )
| A. | 紫色石蕊试液 | B. | 浓溴水 | C. | 新制Cu(OH)2悬浊液 | D. | FeCl3溶液 |