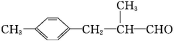
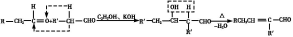
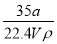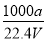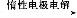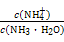题目内容
一定温度下,向一容积为5 L的恒容密闭容器中充入0.4 mol SO2和0.2 mol O2,发生反应:2SO2(g)+O2(g) 2SO3(g) ΔH=-196 kJ·mol-1。当反应达到平衡时,容器内压强变为起始时的0.7倍。请回答下列问题:
2SO3(g) ΔH=-196 kJ·mol-1。当反应达到平衡时,容器内压强变为起始时的0.7倍。请回答下列问题:
(1)判断该反应达到平衡状态的标志是 (填字母)。
a.SO2、O2、SO3三者的浓度之比为2∶1∶2
b.容器内气体的压强不变
c.容器内混合气体的密度保持不变
d.SO3的物质的量不再变化
e.SO2的生成速率和SO3的生成速率相等
(2)①SO2的转化率为 ;②达到平衡时反应放出的热量为 ;③此温度下该反应的平衡常数K= 。
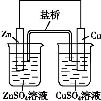
(3)如图表示平衡时SO2的体积分数随压强和温度变化的曲线,则:
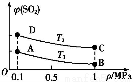
①温度关系:T1 T2(填“>”、“<”或“=”,下同);
②平衡常数关系:KA KB,KA KD。
(1)b、d、e (2)①90% ②35.28 kJ ③20 250
(3)①< ②= >
【解析】(1)SO2、O2、SO3三者浓度比为2∶1∶2,与平衡状态无必然联系,不能作为建立平衡的标志,容器内气体压强随反应进行而变化,气体压强不变,则建立平衡;气体总质量不变,容器体积不变,混合气体密度也不变,不能作为平衡状态标志;SO3的物质的量是随反应进行而发生变化的,当其不变时,表示反应已建立平衡;SO2的生成速率是v(SO2)逆,SO3生成速率是v(SO3)正,而v(SO2)正=v(SO3)正,则有v(SO2)逆=v(SO2)正,这是平衡建立的根本标志。所以可作为平衡状态标志的是b、d、e。
(2) 2SO2(g)+O2(g)  2SO3(g)
2SO3(g)
起始(mol) 0.4 0.2 0
变化(mol) x x/2 x
平衡(mol) 0.4-x 0.2-x/2 x
T、V恒定,气体的压强之比等于物质的量之比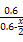 =
=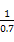 ,解得x=0.36,故SO2转化率为:
,解得x=0.36,故SO2转化率为: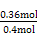 ×100%=90%。放出热量为:
×100%=90%。放出热量为: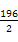 kJ·mol-1×0.4 mol×90%=35.28 kJ,K=
kJ·mol-1×0.4 mol×90%=35.28 kJ,K=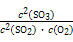 =
=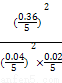 =20 250。
=20 250。
(3)该反应是放热反应,温度升高平衡左移,SO2体积分数增大,所以T2>T1,平衡常数只与温度有关,温度不变,K值不变,则KA=KB,升温,平衡左移,K值减小,KA>KD。

 一线名师提优试卷系列答案
一线名师提优试卷系列答案已知合成氨反应N2(g)+3H2(g) 2NH3(g) ΔH=-92.20 kJ·mol-1,在某温度下2 L的密闭容器中进行,测得如下数据:
2NH3(g) ΔH=-92.20 kJ·mol-1,在某温度下2 L的密闭容器中进行,测得如下数据:
时间(h) 物质的量(mol) | 0 | 1 | 2 | 3 | 4 |
N2 | 1.50 | n1 | 1.20 | n3 | n5 |
H2 | 4.50 | 4.20 | 3.60 | n4 | n6 |
NH3 | 0 | 0.20 | n2 | 1.00 | 1.00 |
下列说法正确的是( )
A.反应3 h内,反应速率v(N2)为0.17 mol·L-1·h-1
B.此温度下,该反应的平衡常数为0.037
C.反应进行到1 h时放出的热量为9.22 kJ
D.4 h时,若再加入1 mol N2,达到新的化学平衡时,N2的转化率是原来的两倍