ΧβΡΩΡΎ»ί
AΓΔBΓΔCΓΔDΓΔEΈΣ‘≠Ή”–ρ ΐ“ά¥Έ‘ω¥σΒΡΈε÷÷ΕΧ÷ήΤΎ‘ΣΥΊ,Τδ÷–ΫωΚ§”–“Μ÷÷Ϋπ τ‘ΣΥΊ,AΚΆDΉνΆβ≤ψΒγΉ” ΐœύΆ§;BΓΔCΚΆE‘Ύ÷ήΤΎ±μ÷–œύΝΎ,«“CΓΔEΆ§÷ςΉεΓΘBΓΔCΒΡΉνΆβ≤ψΒγΉ” ΐ÷°ΚΆΒ»”ΎDΒΡ‘≠Ή”ΚΥΆβΒγΉ” ΐ,AΚΆCΩ…–Έ≥…ΝΫ÷÷≥ΘΦϊΒΡ“ΚΧ§Μ·ΚœΈοΓΘ «κΜΊ¥πœ¬Ν–Έ Χβ:
(1)BΒΡ‘≠Ή”ΫαΙΙ Ψ“βΆΦ ΓΘ
(2)CΓΔDΓΔE»ΐ÷÷‘≠Ή”Ε‘”ΠΒΡάκΉ”ΑκΨΕ”…¥σΒΫ–ΓΒΡΥ≥–ρ « (ΧνΨΏΧεάκΉ”);”…AΓΔBΓΔC»ΐ÷÷‘ΣΥΊΑ¥4ΓΟ2ΓΟ3Ήι≥…ΒΡΜ·ΚœΈοΥυΚ§ΒΡΜ·―ßΦϋάύ–ΆΈΣ ΓΘ
(3)”ΟΡ≥÷÷ΖœΤζΒΡΫπ τ“Ήά≠Ιό”κAΓΔCΓΔDΉι≥…ΒΡΜ·ΚœΈο»ή“ΚΖ¥”Π,ΗΟΖ¥”ΠΒΡάκΉ”ΖΫ≥Χ ΫΈΣ: ΓΘ
(4)‘Ύ100 mL 18 mol/LΒΡ≈®ΒΡAΓΔCΓΔEΉι≥…ΒΡΥα»ή“Κ÷–Φ”»κΙΐΝΩΒΡΆ≠Τ§,Φ”»» Ι÷°≥δΖ÷Ζ¥”Π, ≤ζ…ζΒΡΤχΧε‘Ύ±ξΉΦΉ¥Ωωœ¬ΒΡΧεΜΐΩ…Ρή « (Χν–ρΚ≈);
a.7.32 L b.6.72 L c.20.16 L d.30.24 L
»τ Ι…œ ωΖ¥”Π÷– Θ”ύΒΡΆ≠Τ§ΦΧ–χ»ήΫβ,Ω…œρΤδ÷–Φ”»κœθΥαΡΤ,Ζ¥”ΠΒΡάκΉ”ΖΫ≥Χ ΫΈΣ: ΓΘ
(5)AΓΔCΝΫ‘ΣΥΊΒΡΒΞ÷ ”κ»έ»ΎK2CO3Ήι≥…ΒΡ»ΦΝœΒγ≥Ί,ΤδΗΚΦΪΖ¥”Π ΫΈΣ ,”ΟΗΟΒγ≥ΊΒγΫβ1 L 1 mol/L NaCl»ή“ΚΒ±œϊΚΡ±ξΉΦΉ¥Ωωœ¬1.12 L H2 ±,NaCl»ή“ΚΒΡpH= (ΦΌ…ηΒγΫβΙΐ≥Χ÷–»ή“ΚΒΡΧεΜΐ≤Μ±δ)ΓΘ
(1) (2)S2-ΘΨO2-ΘΨNa+ Ι≤ΦέΦϋΚΆάκΉ”Φϋ
(2)S2-ΘΨO2-ΘΨNa+ Ι≤ΦέΦϋΚΆάκΉ”Φϋ
(3)2Al+2OH-+2H2O=2Al +3H2Γϋ
+3H2Γϋ
(4)ab 3Cu+8H++2N =3Cu2++2NOΓϋ+4H2O
=3Cu2++2NOΓϋ+4H2O
(5)H2+C -2e-=CO2Γϋ+H2O 13
-2e-=CO2Γϋ+H2O 13
ΓΨΫβΈωΓΩ”…”ΎAΚΆCΩ…–Έ≥…ΝΫ÷÷≥ΘΦϊΒΡ“ΚΧ§Μ·ΚœΈο,«“CΒΡ‘≠Ή”–ρ ΐ¥σ,Ι AΈΣH,CΈΣO,ΫαΚœCΓΔEΈΣΆ§÷ςΉεΒΡΕΧ÷ήΤΎ‘ΣΥΊ,‘ρEΈΣS;”÷ΨίAΓΔDΉνΆβ≤ψΒγΉ” ΐœύΆ§,Ι DΈΣNa;‘ΌΨίBΓΔCΒΡΉνΆβ≤ψΒγΉ” ΐ÷°ΚΆΒ»”ΎDΒΡ‘≠Ή”ΚΥΆβΒγΉ” ΐ,‘ρBΈΣNΓΘΙ (1)NΒΡ‘≠Ή”ΫαΙΙ Ψ“βΆΦΈΣ ΓΘ(2)ΒγΉ”≤ψ ΐ‘ΫΕύ,άκΉ”ΒΡΑκΨΕ‘Ϋ¥σ,ΕχΒγΉ”≤ψΫαΙΙœύΆ§ΒΡάκΉ”,ΓΑΚΥ¥σΨΕ–ΓΓ±,Ι άκΉ”ΑκΨΕ¥σ–ΓΥ≥–ρΈΣS2-ΘΨO2-ΘΨNa+,”…AΓΔBΓΔC»ΐ÷÷‘ΣΥΊΑ¥4ΓΟ2ΓΟ3Ήι≥…ΒΡΜ·ΚœΈο «NH4NO3,NH4NO3÷–Κ§”–άκΉ”ΦϋΚΆΙ≤ΦέΦϋΓΘ(3)AlΚΆNaOH»ή“ΚΖ¥”Π…ζ≥…NaAlO2ΚΆH2,άκΉ”ΖΫ≥Χ ΫΈΣ2Al+2OH-+2H2O=2Al
ΓΘ(2)ΒγΉ”≤ψ ΐ‘ΫΕύ,άκΉ”ΒΡΑκΨΕ‘Ϋ¥σ,ΕχΒγΉ”≤ψΫαΙΙœύΆ§ΒΡάκΉ”,ΓΑΚΥ¥σΨΕ–ΓΓ±,Ι άκΉ”ΑκΨΕ¥σ–ΓΥ≥–ρΈΣS2-ΘΨO2-ΘΨNa+,”…AΓΔBΓΔC»ΐ÷÷‘ΣΥΊΑ¥4ΓΟ2ΓΟ3Ήι≥…ΒΡΜ·ΚœΈο «NH4NO3,NH4NO3÷–Κ§”–άκΉ”ΦϋΚΆΙ≤ΦέΦϋΓΘ(3)AlΚΆNaOH»ή“ΚΖ¥”Π…ζ≥…NaAlO2ΚΆH2,άκΉ”ΖΫ≥Χ ΫΈΣ2Al+2OH-+2H2O=2Al +3H2ΓϋΓΘ(4)AΓΔCΓΔEΉι≥…ΒΡΥαΈΣH2SO4,≈®H2SO4ΚΆCuΖ¥”ΠΒΪœΓH2SO4ΚΆCu≤ΜΖ¥”Π,Ι …ζ≥…SO2ΒΡΈο÷ ΒΡΝΩ–Γ”ΎΝρΥαΒΡ“ΜΑκ,ΗυΨίΝρ‘≠Ή” ΊΚψ÷Σ,ΤχΧεΒΡΧεΜΐ–Γ”Ύ20.16 L,Ι ―ΓaΓΔbΓΘ»τΦ”»κNaNO3,ΧαΙ©ΒΡN
+3H2ΓϋΓΘ(4)AΓΔCΓΔEΉι≥…ΒΡΥαΈΣH2SO4,≈®H2SO4ΚΆCuΖ¥”ΠΒΪœΓH2SO4ΚΆCu≤ΜΖ¥”Π,Ι …ζ≥…SO2ΒΡΈο÷ ΒΡΝΩ–Γ”ΎΝρΥαΒΡ“ΜΑκ,ΗυΨίΝρ‘≠Ή” ΊΚψ÷Σ,ΤχΧεΒΡΧεΜΐ–Γ”Ύ20.16 L,Ι ―ΓaΓΔbΓΘ»τΦ”»κNaNO3,ΧαΙ©ΒΡN ”κH+”÷”κCuΖ¥”Π:3Cu+8H++2N
”κH+”÷”κCuΖ¥”Π:3Cu+8H++2N =3Cu2++2NOΓϋ+4H2OΓΘ(5)Ήι≥…ΒΡΒγ≥Ί ««β―θ»ΦΝœΒγ≥Ί,ΗΚΦΪ…œH2 ß»ΞΒγΉ”ΚΆC
=3Cu2++2NOΓϋ+4H2OΓΘ(5)Ήι≥…ΒΡΒγ≥Ί ««β―θ»ΦΝœΒγ≥Ί,ΗΚΦΪ…œH2 ß»ΞΒγΉ”ΚΆC Ζ¥”Π…ζ≥…CO2ΚΆΥ°,ΒγΦΪΖ¥”Π ΫΈΣH2+C
Ζ¥”Π…ζ≥…CO2ΚΆΥ°,ΒγΦΪΖ¥”Π ΫΈΣH2+C -2e-=CO2Γϋ+H2OΓΘΒ±œϊΚΡ±ξΉΦΉ¥Ωωœ¬1.12 L H2Φ¥n(H2)=0.05 mol,‘ρΒγΫβNaCl»ή“Κ ±œϊΚΡH2OΒγάκ≥ωΒΡH+ΒΡΈο÷ ΒΡΝΩΈΣ0.1 mol,‘ρ≤ζ…ζΒΡn(OH-)=0.1 mol,Φ¥ c(OH-)=
-2e-=CO2Γϋ+H2OΓΘΒ±œϊΚΡ±ξΉΦΉ¥Ωωœ¬1.12 L H2Φ¥n(H2)=0.05 mol,‘ρΒγΫβNaCl»ή“Κ ±œϊΚΡH2OΒγάκ≥ωΒΡH+ΒΡΈο÷ ΒΡΝΩΈΣ0.1 mol,‘ρ≤ζ…ζΒΡn(OH-)=0.1 mol,Φ¥ c(OH-)= =0.1 mol/L,Υυ“‘pH=13ΓΘ
=0.1 mol/L,Υυ“‘pH=13ΓΘ

 ΈΡΨ¥ΆΦ ιΩΈ ±œ»ΖφœΒΝ–¥πΑΗ
ΈΡΨ¥ΆΦ ιΩΈ ±œ»ΖφœΒΝ–¥πΑΗ(1)–¬ΒΡΓΕΜΖΨ≥Ω’Τχ÷ ΝΩ±ξΉΦΓΖ(GB 3095 2012)ΫΪ”Ύ2016Ρξ1‘¬1»’‘ΎΈ“Ιζ»ΪΟφ Β ©ΓΘΨί¥Υ,ΜΖΨ≥Ω’Τχ÷ ΝΩ÷Η ΐ(AQI)»’±®ΚΆ Β ±±®ΗφΑϋά®ΝΥSO2ΓΔNO2ΓΔCOΓΔO3ΓΔPM10ΓΔPM2.5Β»÷Η±ξ,ΈΣΙΪ÷ΎΧαΙ©ΫΓΩΒ÷Η“ΐ,“ΐΒΦΒ±ΒΊΨ”ΟώΚœάμΑ≤≈≈≥ω––ΚΆ…ζΜνΓΘ
2012)ΫΪ”Ύ2016Ρξ1‘¬1»’‘ΎΈ“Ιζ»ΪΟφ Β ©ΓΘΨί¥Υ,ΜΖΨ≥Ω’Τχ÷ ΝΩ÷Η ΐ(AQI)»’±®ΚΆ Β ±±®ΗφΑϋά®ΝΥSO2ΓΔNO2ΓΔCOΓΔO3ΓΔPM10ΓΔPM2.5Β»÷Η±ξ,ΈΣΙΪ÷ΎΧαΙ©ΫΓΩΒ÷Η“ΐ,“ΐΒΦΒ±ΒΊΨ”ΟώΚœάμΑ≤≈≈≥ω––ΚΆ…ζΜνΓΘ
ΔΌΤϊ≥Β≈≈≥ωΒΡΈ≤Τχ÷–Κ§”–COΚΆNOΒ»ΤχΧε,”ΟΜ·―ßΖΫ≥Χ ΫΫβ Ά≤ζ…ζNOΒΡ‘≠“ρ ΓΘ
ΔΎΤϊ≥Β≈≈ΤχΙήΡΎΑ≤ΉΑΒΡ¥ΏΜ·ΉΣΜ·Τς,Ω… ΙΤϊ≥ΒΈ≤Τχ÷–ΒΡ÷ς“ΣΈέ»ΨΈοΉΣΜ·ΈΣΈόΕΨΒΡ¥σΤχ―≠ΜΖΈο÷ ΓΘ“―÷Σ:
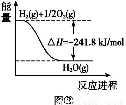
N2(g)+O2(g)=2NO(g) ΠΛH=+180.5 kJ/mol
2C(s)+O2(g)=2CO(g) ΠΛH=-221.0 kJ/mol
C(s)+O2(g)=CO2(g) ΠΛH=-393.5 kJ/mol
‘ρΖ¥”Π2NO(g)+2CO(g)=N2(g)+2CO2(g)ΒΡΠΛH= kJ/molΓΘ
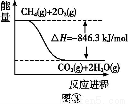
(2)÷±Ϋ”≈≈Ζ≈ΒΣ―θΜ·ΈοΜα–Έ≥…Υα”ξΓΔΈμω≤,¥ΏΜ·ΜΙ‘≠Ζ®ΚΆ―θΜ·Έϋ ’Ζ® «≥Θ”ΟΒΡ¥ΠάμΖΫΖ®ΓΘάϊ”ΟNH3ΚΆCH4Β»ΤχΧε≥ΐ»Ξ―ΧΤχ÷–ΒΡΒΣ―θΜ·ΈοΓΘ“―÷Σ:CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΠΛH1=a kJ/mol;”ϊΦΤΥψΖ¥”ΠCH4(g)+4NO(g)=CO2(g)+2H2O(l)+2N2(g)ΒΡλ ±δΠΛH2‘ρΜΙ–η“Σ≤ι―·Ρ≥Ζ¥”ΠΒΡλ ±δΠΛH3,Β±Ζ¥”Π÷–ΗςΈο÷ ΒΡΜ·―ßΦΤΝΩ ΐ÷°±»ΈΣΉνΦρ’ϊ ΐ±» ±,ΠΛH3=b kJ/mol,ΗΟΖ¥”ΠΒΡ»»Μ·―ßΖΫ≥Χ Ϋ « ,Ψί¥ΥΦΤΥψ≥ωΠΛH2= kJ/mol(”ΟΚ§aΓΔbΒΡ ΫΉ”±μ Ψ)ΓΘ
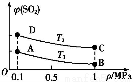
(3)œ¬±μΝ–≥ωΝΥΙΛ“Β…œΈϋ ’SO2ΒΡ»ΐ÷÷ΖΫΖ®ΓΘ
ΖΫΖ®Δώ | ”ΟΑ±Υ°ΫΪSO2ΉΣΜ·(NH4)2SO3,‘Ό―θΜ·≥…(NH4)2SO4 |
ΖΫΖ®Δρ | ”Ο…ζΈο÷ »»ΫβΤχ(÷ς“Σ≥…Ζ÷COΓΔCH4ΓΔH2)ΫΪSO2‘ΎΗΏΈ¬œ¬ΜΙ‘≠≥…ΒΞ÷ Νρ |
ΖΫΖ®Δσ | ”ΟNa2SO3»ή“ΚΈϋ ’SO2,‘ΌΨ≠ΒγΫβΉΣΜ·ΈΣH2SO4 |
ΖΫΖ®Δρ÷ς“ΣΖΔ…ζΝΥœ¬Ν–Ζ¥”Π:
2CO(g)+SO2(g)=S(g)+2CO2(g) ΠΛH=+8.0 kJ/mol
2H2(g)+SO2(g)=S(g)+2H2O(g)ΠΛH=+90.4 kJ/mol
2CO(g)+O2(g)=2CO2(g) ΠΛH=-566.0 kJ/mol
2H2(g)+O2(g)=2H2O(g) ΠΛH=-483.6 kJ/mol
‘ρS(g)”κO2(g)Ζ¥”Π…ζ≥…SO2(g)ΒΡ»»Μ·―ßΖΫ≥Χ ΫΩ…±μ ΨΈΣ ΓΘ
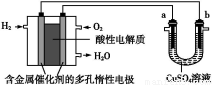
(4)Κœ≥…Α±”ΟΒΡ«βΤχΩ…“‘ΦΉΆιΈΣ‘≠Νœ÷ΤΒΟΓΘ”–ΙΊΜ·―ßΖ¥”ΠΒΡΡήΝΩ±δΜ·»γΆΦΥυ Ψ,‘ρCH4(g)”κH2O(g)Ζ¥”Π…ζ≥…CO(g)ΚΆH2(g)ΒΡ»»Μ·―ßΖΫ≥Χ ΫΈΣ ΓΘ