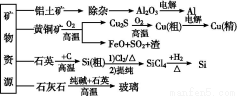
题目内容
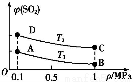
已知合成氨反应N2(g)+3H2(g) 2NH3(g) ΔH=-92.20 kJ·mol-1,在某温度下2 L的密闭容器中进行,测得如下数据:
2NH3(g) ΔH=-92.20 kJ·mol-1,在某温度下2 L的密闭容器中进行,测得如下数据:
时间(h) 物质的量(mol) | 0 | 1 | 2 | 3 | 4 |
N2 | 1.50 | n1 | 1.20 | n3 | n5 |
H2 | 4.50 | 4.20 | 3.60 | n4 | n6 |
NH3 | 0 | 0.20 | n2 | 1.00 | 1.00 |
下列说法正确的是( )
A.反应3 h内,反应速率v(N2)为0.17 mol·L-1·h-1
B.此温度下,该反应的平衡常数为0.037
C.反应进行到1 h时放出的热量为9.22 kJ
D.4 h时,若再加入1 mol N2,达到新的化学平衡时,N2的转化率是原来的两倍
C
【解析】通过反应方程式可求得:n1=1.4,n2=0.6,n3=1.0,n5=1.0,n4=3.0,n6=3.0,3 h内v(N2)= =0.083 mol·L-1·h-1,A选项错;由上面计算数据可知3 h时已建立平衡,K=
=0.083 mol·L-1·h-1,A选项错;由上面计算数据可知3 h时已建立平衡,K=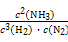 =
= =
=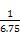 =0.148,B选项错,反应进行到1 h放出热量
=0.148,B选项错,反应进行到1 h放出热量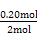 ×92.20 kJ=9.22 kJ,C选项正确,4 h时,再充入1 mol N2,平衡右移,H2转化率增大,而N2转化率降低,D选项错。
×92.20 kJ=9.22 kJ,C选项正确,4 h时,再充入1 mol N2,平衡右移,H2转化率增大,而N2转化率降低,D选项错。

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目