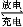题目内容
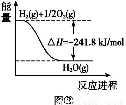
已知:①2H2(g)+O2(g) 2H2O(g)ΔH=-483.6 kJ/mol
2H2O(g)ΔH=-483.6 kJ/mol
②H2(g)+S(g)=H2S(g) ΔH=-20.1 kJ/mol。下列判断正确的是( )
A.1 mol氢气完全燃烧吸热241.8 kJ
B.1 mol H2O(g)和1 mol H2S(g)的能量相差221.7 kJ
C.由①②知,水的热稳定性小于硫化氢
D.若反应②中改用固态硫,1 mol S(s)完全反应,放出的热量小于20.1 kJ
D
【解析】H2燃烧是放热反应,A项错误;根据已知的热化学方程式可知生成1 mol H2O(g)与1 mol H2S(g)时两反应放出的热量差为221.7 kJ,B项错误;由于前者放热多,能量低,故稳定性强,C项错误;由于固态硫汽化时需要吸收热量,故放出的热量小于20.1 kJ,D项正确。

 阅读快车系列答案
阅读快车系列答案(1)新的《环境空气质量标准》(GB 3095 2012)将于2016年1月1日在我国全面实施。据此,环境空气质量指数(AQI)日报和实时报告包括了SO2、NO2、CO、O3、PM10、PM2.5等指标,为公众提供健康指引,引导当地居民合理安排出行和生活。
2012)将于2016年1月1日在我国全面实施。据此,环境空气质量指数(AQI)日报和实时报告包括了SO2、NO2、CO、O3、PM10、PM2.5等指标,为公众提供健康指引,引导当地居民合理安排出行和生活。
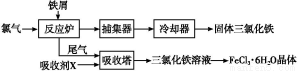
①汽车排出的尾气中含有CO和NO等气体,用化学方程式解释产生NO的原因 。
②汽车排气管内安装的催化转化器,可使汽车尾气中的主要污染物转化为无毒的大气循环物质。已知:
N2(g)+O2(g)=2NO(g) ΔH=+180.5 kJ/mol
2C(s)+O2(g)=2CO(g) ΔH=-221.0 kJ/mol
C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ/mol
则反应2NO(g)+2CO(g)=N2(g)+2CO2(g)的ΔH= kJ/mol。
(2)直接排放氮氧化物会形成酸雨、雾霾,催化还原法和氧化吸收法是常用的处理方法。利用NH3和CH4等气体除去烟气中的氮氧化物。已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1=a kJ/mol;欲计算反应CH4(g)+4NO(g)=CO2(g)+2H2O(l)+2N2(g)的焓变ΔH2则还需要查询某反应的焓变ΔH3,当反应中各物质的化学计量数之比为最简整数比时,ΔH3=b kJ/mol,该反应的热化学方程式是 ,据此计算出ΔH2= kJ/mol(用含a、b的式子表示)。
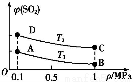
(3)下表列出了工业上吸收SO2的三种方法。
方法Ⅰ | 用氨水将SO2转化(NH4)2SO3,再氧化成(NH4)2SO4 |
方法Ⅱ | 用生物质热解气(主要成分CO、CH4、H2)将SO2在高温下还原成单质硫 |
方法Ⅲ | 用Na2SO3溶液吸收SO2,再经电解转化为H2SO4 |
方法Ⅱ主要发生了下列反应:
2CO(g)+SO2(g)=S(g)+2CO2(g) ΔH=+8.0 kJ/mol
2H2(g)+SO2(g)=S(g)+2H2O(g)ΔH=+90.4 kJ/mol
2CO(g)+O2(g)=2CO2(g) ΔH=-566.0 kJ/mol
2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ/mol
则S(g)与O2(g)反应生成SO2(g)的热化学方程式可表示为 。
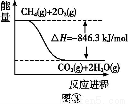
(4)合成氨用的氢气可以甲烷为原料制得。有关化学反应的能量变化如图所示,则CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为 。