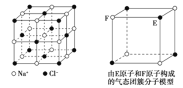
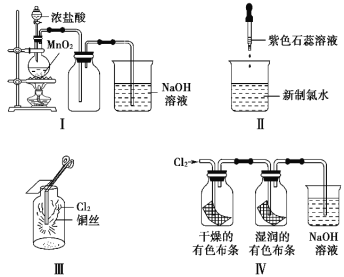
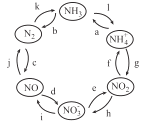
题目内容
【题目】下列说法正确的是![]()
A.酸碱中和滴定时,滴定管和锥形瓶在使用前均需用待装液润洗
B.清洗碘升华实验所用试管,先用稀盐酸清洗,再用水清洗
C.实验室从海带提取单质碘的方法是:取样![]() 灼烧
灼烧![]() 溶解
溶解![]() 过滤
过滤![]() 萃取
萃取
D.配制![]() 溶液时未恢复至室温就转移并定容,所得溶液浓度偏小
溶液时未恢复至室温就转移并定容,所得溶液浓度偏小
【答案】D
【解析】
A、酸碱中和试验中,锥形瓶不能润洗,否则导致待测液中溶质的物质的量存在误差;
B、碘易溶于酒精,但是不溶于盐酸中;
C、碘元素在海水中只有化合态,没有游离态,海带提取单质碘需将碘离子氧化成碘单质;
D、硝酸铵溶于水吸热,冷的溶液体积偏小,恢复室温后所得溶液体积偏大。
A、中和滴定中,锥形瓶不能用待测液润洗,否则导致待测液中溶质的物质的量偏大,消耗的标准液体积偏大,测定结果偏高,故A错误;
B、碘易溶于酒精,清洗碘升华实验所用试管,先用酒精清洗,再用水清洗,故B错误;
C、海水中只有化合态的碘,实验室从海带提取单质碘的方法是:取样![]() 灼烧
灼烧![]() 溶解
溶解![]() 过滤,然后需将碘离子氧化为碘单质,在提取的过程中用的氧化剂可以是
过滤,然后需将碘离子氧化为碘单质,在提取的过程中用的氧化剂可以是![]() ,然后再萃取,故C错误;
,然后再萃取,故C错误;
D、![]() 溶于水后吸收热量,未恢复至室温就转移并定容,最终配制溶液的体积偏大,溶液的浓度偏小,故D正确;
溶于水后吸收热量,未恢复至室温就转移并定容,最终配制溶液的体积偏大,溶液的浓度偏小,故D正确;
故选:D。

【题目】水是生命的源泉、工业的血液、城市的命脉。要保护好河流,河水是重要的饮用水源,污染物通过饮用水可直接毒害人体。也可通过食物链和灌溉农田间接危及健康。请回答下列问题:
(1)25℃时,向水的电离平衡体系中加入少量碳酸钠固体,得到pH为11的溶液,其水解的离子方程式为________,由水电离出的c(OH-)=_______mol/L
(2)纯水在100℃时,pH=6,该温度下1mol/L的NaOH溶液中,由水电离出的 c(OH-)=_______mol/L。
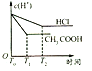
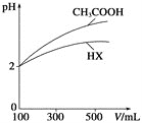
(3)体积均为100mL、pH均为2的CH3COOH溶液与一元酸HX溶液,加水稀释过程中pH与溶液体积的关系如下图所示,则HX的电离平衡常数___(填”大于””小于”或“等于”)CH3COOH的电离平衡常数。
(4)电离平衡常数是衡量弱电解质电离程度强弱的物理量。已知:
化学式 | 电离平衡常数(25℃) |
HCN | K=4.9×10-10 |
CH3COOH | K==1.8×10-5 |
H2CO3 | K1=4.3×10-7、K2=5.610-11 |
①25℃时,有等浓度的NaCN溶液、Na2CO3液和CH3COONa溶液,三种溶液的pH由大到小的顺序为___。
②向NaCN溶液中通入少量的CO2,发生反应的化学方程式为______
(5)25℃时,在CH3COOH与CH3COONa的混合溶液中,若测得pH=6,则溶液中 c(CH3COO-)-c(Na+)=_____(填精确值)mol/L