题目内容
【题目】水是生命的源泉、工业的血液、城市的命脉。要保护好河流,河水是重要的饮用水源,污染物通过饮用水可直接毒害人体。也可通过食物链和灌溉农田间接危及健康。请回答下列问题:
(1)25℃时,向水的电离平衡体系中加入少量碳酸钠固体,得到pH为11的溶液,其水解的离子方程式为________,由水电离出的c(OH-)=_______mol/L
(2)纯水在100℃时,pH=6,该温度下1mol/L的NaOH溶液中,由水电离出的 c(OH-)=_______mol/L。
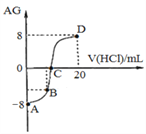
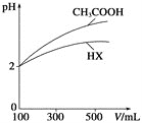
(3)体积均为100mL、pH均为2的CH3COOH溶液与一元酸HX溶液,加水稀释过程中pH与溶液体积的关系如下图所示,则HX的电离平衡常数___(填”大于””小于”或“等于”)CH3COOH的电离平衡常数。
(4)电离平衡常数是衡量弱电解质电离程度强弱的物理量。已知:
化学式 | 电离平衡常数(25℃) |
HCN | K=4.9×10-10 |
CH3COOH | K==1.8×10-5 |
H2CO3 | K1=4.3×10-7、K2=5.610-11 |
①25℃时,有等浓度的NaCN溶液、Na2CO3液和CH3COONa溶液,三种溶液的pH由大到小的顺序为___。
②向NaCN溶液中通入少量的CO2,发生反应的化学方程式为______
(5)25℃时,在CH3COOH与CH3COONa的混合溶液中,若测得pH=6,则溶液中 c(CH3COO-)-c(Na+)=_____(填精确值)mol/L
【答案】CO32—+H2O![]() HCO3—+OH-、HCO3—+H2O
HCO3—+OH-、HCO3—+H2O![]() H2CO3+OH- 10-3 10-12 小于 pH(Na2CO3溶液)>pH(NaCN溶液)>pH(CH3COONa溶液) NaCN+H2O+CO2=HCN+NaHCO3 9.9×10-7
H2CO3+OH- 10-3 10-12 小于 pH(Na2CO3溶液)>pH(NaCN溶液)>pH(CH3COONa溶液) NaCN+H2O+CO2=HCN+NaHCO3 9.9×10-7
【解析】
(1)碳酸钠溶液中因碳酸根离子水解导致溶液显碱性,盐溶液中盐的水解促进水的电离;
(2)纯水在100℃时,pH=6,Kw=10-12,据此计算水电离出的氢氧根离子浓度;
(3)据图分析,加水稀释的过程中,HX的pH变化比较慢,说明HX的酸性比醋酸弱;
(4)①根据酸的电离常数进行分析判断,电离常数越大,对应盐的水解程度越小,溶液的pH越小;
②电离平衡常数越大,酸的酸性越强,根据表中数据可知酸性:H2CO3>HCN>HCO3-,向NaCN溶液中通入少量CO2,反应生成HCN和碳酸氢钠,据此写出反应的化学方程式;
(5)溶液中的电荷守恒来分析,c(CH3COO-)+c(OH-)=c(Na+)+c(H+),因此c(CH3COO-)-c(Na+)= c(H+)-c(OH-)。
(1)碳酸钠溶液中因碳酸根离子水解导致溶液显碱性,碳酸根水解的离子方程式为CO32—+H2O![]() HCO3—+OH-、HCO3—+H2O
HCO3—+OH-、HCO3—+H2O![]() H2CO3+OH-,其pH=11,则c(OH-)=0.001mol/L,全部由水电离产生,故答案为:CO32—+H2O
H2CO3+OH-,其pH=11,则c(OH-)=0.001mol/L,全部由水电离产生,故答案为:CO32—+H2O![]() HCO3—+OH-、HCO3—+H2O
HCO3—+OH-、HCO3—+H2O![]() H2CO3+OH-;0.001;
H2CO3+OH-;0.001;
(2)纯水在100℃时,pH=6,Kw=10-12,该温度下1mol![]() L-1的NaOH溶液中,由水电离出的c(OH-)=c(H+)=10-12mol/L,故答案为:10-12;
L-1的NaOH溶液中,由水电离出的c(OH-)=c(H+)=10-12mol/L,故答案为:10-12;
(3)据图分析,加水稀释的过程中,HX的pH变化比较慢,说明HX的酸性比醋酸弱,HX的电离平衡常数比醋酸小,故答案为:小于;
(4)①根据图表数据分析,电离常数:醋酸>HCN>碳酸氢根离子,所以等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液水解程度为:Na2CO3溶液>NaCN溶液>CH3COONa溶液,故溶液的pH为:Na2CO3溶液>NaCN溶液>CH3COONa溶液,故答案为:pH(Na2CO3溶液)>pH(NaCN溶液)>pH(CH3COONa溶液);
②根据电离平衡常数大小可知酸性:H2CO3>HCN>HCO3-,向NaCN溶液中通入少量CO2,反应生成HCN和碳酸氢钠,不能生成二氧化碳,反应的化学方程式为:NaCN+H2O+CO2=HCN+NaHCO3,故答案为:NaCN+H2O+CO2=HCN+NaHCO3;
(5)25℃时,CH3COOH和CH3COONa的混合溶液,若测得混合液的pH=6,即c(H+)=10-6
根据电荷守恒可知:c(CH3COO-)+c(OH-)=c(Na+)+c(H+),因此c(CH3COO-)-c(Na+)= c(H+)-c(OH-)=10-6mol/L-10-8mol/L=9.9×10-7mol/L,故答案为:9.9×10-7。

【题目】按要求回答下列问题:
(1)以CO2和NH3为原料合成尿素是利用CO2的成功范例。在尿素合成塔中的主要反应可表示如下:
反应Ⅰ:2NH3(g)+CO2(g)![]() NH2COONH4(s) △H1
NH2COONH4(s) △H1
反应Ⅱ:NH2COONH4(s)![]() CO(NH2)2(s)+H2O(g) △H2= +72.49kJ/mol
CO(NH2)2(s)+H2O(g) △H2= +72.49kJ/mol
总反应:2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g) △H3= -86.98kJ/mol
CO(NH2)2(s)+H2O(g) △H3= -86.98kJ/mol
①反应Ⅰ的△H1=______________。
②一定温度下,在体积固定的密闭容器中按 n(NH3):n(CO2)=2:1 进行反应Ⅰ,下列能说明反应Ⅰ达到了平衡状态的是_______(填序号)。
A 容器内气体总压强不再变化
B NH3与CO2的转化率相等
C 容器内混合气体的密度不再变化
(2)在一定体积的密闭容器中进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如下表所示:
t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
①该反应的化学平衡常数表达式为K=___________。
②该反应为____________(填“吸热”或“放热”)反应。
③某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为________℃。
④在800 ℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)为2 mol·L-1,c(H2)为1.5 mol·L-1,c(CO)为1 mol·L-1,c(H2O)为3 mol·L-1,此时反应向________(填“正向”或“逆向”)进行。
(3)工业上从废铅蓄电池废液回收铅的过程中,常用纯碱溶液与处理后的铅膏(主要含PbSO4)发生反应:PbSO4(s)+CO32-(aq)![]() PbCO3(s)+SO42-(aq)。已知溶度积常数:Ksp(PbSO4)=1.6×10-8,Ksp(PbCO3)=7.4×10-14,则该反应的化学平衡常数K =____。
PbCO3(s)+SO42-(aq)。已知溶度积常数:Ksp(PbSO4)=1.6×10-8,Ksp(PbCO3)=7.4×10-14,则该反应的化学平衡常数K =____。