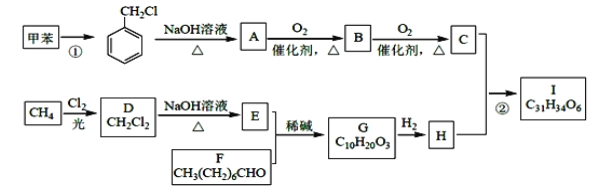
题目内容
【题目】中学化学涉及多种常数,下列说法正确的是( )
A.两种物质反应,不管怎样书写化学方程式,平衡常数不变
B.某温度下,2L密闭容器中加入4mol A和2mol B发生反应:
3A(g)+2B(g)![]() 4C(s)+2D(g)。平衡时测得n(C)=1.6mol,反应的化学平衡常数表达式为K=
4C(s)+2D(g)。平衡时测得n(C)=1.6mol,反应的化学平衡常数表达式为K=![]()
C.温度一定时,当溶液中c(Ag+ )· c(Cl-)等于Ksp值时,此溶液为AgCl的饱和溶液
D.难溶电解质AB2饱和溶液中,c(A2+ )=x mol·L﹣1,c(B—)=y mol·L﹣1,则Ksp值为4xy2
【答案】C
【解析】
试题分析:A、平衡常数是用生成物浓度的幂次方乘积除以反应物的幂次方乘积计算,和化学方程式书写有关,系数变化,平衡常数变化,故A错误;B、固体和液体不写入平衡常数表达式中,3A(g)+2B(g)![]() 4C(s)+2D( g).平衡常数K=
4C(s)+2D( g).平衡常数K= ,故B错误;C、沉淀溶解平衡状态下离子浓度幂次方乘积等于Ksp达到沉淀溶解平衡,形成饱和溶液,温度一定时,当溶液中(Ag+)c(Cl-)等于Ksp值时,此溶液为AgCl的饱和溶液,故C正确;D、沉淀溶解平衡状态下饱和溶液中离子浓度的幂次方乘积计算Ksp,AB2饱和溶液中AB2(s)
,故B错误;C、沉淀溶解平衡状态下离子浓度幂次方乘积等于Ksp达到沉淀溶解平衡,形成饱和溶液,温度一定时,当溶液中(Ag+)c(Cl-)等于Ksp值时,此溶液为AgCl的饱和溶液,故C正确;D、沉淀溶解平衡状态下饱和溶液中离子浓度的幂次方乘积计算Ksp,AB2饱和溶液中AB2(s)![]() A2+(aq)+2B-(aq),Ksp=c(A2+)c2(B-)=xy2,故D错误;故选C。
A2+(aq)+2B-(aq),Ksp=c(A2+)c2(B-)=xy2,故D错误;故选C。

 阅读快车系列答案
阅读快车系列答案【题目】按要求回答下列问题:
(1)以CO2和NH3为原料合成尿素是利用CO2的成功范例。在尿素合成塔中的主要反应可表示如下:
反应Ⅰ:2NH3(g)+CO2(g)![]() NH2COONH4(s) △H1
NH2COONH4(s) △H1
反应Ⅱ:NH2COONH4(s)![]() CO(NH2)2(s)+H2O(g) △H2= +72.49kJ/mol
CO(NH2)2(s)+H2O(g) △H2= +72.49kJ/mol
总反应:2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g) △H3= -86.98kJ/mol
CO(NH2)2(s)+H2O(g) △H3= -86.98kJ/mol
①反应Ⅰ的△H1=______________。
②一定温度下,在体积固定的密闭容器中按 n(NH3):n(CO2)=2:1 进行反应Ⅰ,下列能说明反应Ⅰ达到了平衡状态的是_______(填序号)。
A 容器内气体总压强不再变化
B NH3与CO2的转化率相等
C 容器内混合气体的密度不再变化
(2)在一定体积的密闭容器中进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如下表所示:
t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
①该反应的化学平衡常数表达式为K=___________。
②该反应为____________(填“吸热”或“放热”)反应。
③某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为________℃。
④在800 ℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)为2 mol·L-1,c(H2)为1.5 mol·L-1,c(CO)为1 mol·L-1,c(H2O)为3 mol·L-1,此时反应向________(填“正向”或“逆向”)进行。
(3)工业上从废铅蓄电池废液回收铅的过程中,常用纯碱溶液与处理后的铅膏(主要含PbSO4)发生反应:PbSO4(s)+CO32-(aq)![]() PbCO3(s)+SO42-(aq)。已知溶度积常数:Ksp(PbSO4)=1.6×10-8,Ksp(PbCO3)=7.4×10-14,则该反应的化学平衡常数K =____。
PbCO3(s)+SO42-(aq)。已知溶度积常数:Ksp(PbSO4)=1.6×10-8,Ksp(PbCO3)=7.4×10-14,则该反应的化学平衡常数K =____。