题目内容
【题目】Ⅰ.如何降低大气中CO2的含量及有效利用CO2,目前已引起各国普遍重视。
(1)工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1L的密闭容器中,充入1molCO2和3molH2,在500℃下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。实验测得CO2(g)和CH3OH(g)的浓度随时间变化如图1所示。
CH3OH(g)+H2O(g)。实验测得CO2(g)和CH3OH(g)的浓度随时间变化如图1所示。

①从反应开始到平衡,氢气的平均反应速率v(H2)=__;
②图2是改变温度时H2的化学反应速率随时间变化的示意图,则该反应的正反应是__热(填“吸”或“放”)反应。
③该反应的平衡常数K为__(保留两位小数)。若提高温度到800℃进行,达平衡时,K值__(填“增大”、“减小”或“不变”),
④500℃达平衡时,CH3OH的体积分数ω为__。
Ⅱ.(2)工业上可利用煤的气化产物(CO和H2)合成二甲醚(CH3OCH3),其三步反应如下:
①2H2(g)+CO(g)![]() CH3OH(g) △H=-90.8kJmol-1
CH3OH(g) △H=-90.8kJmol-1
②2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H=-23.5kJmol-1
CH3OCH3(g)+H2O(g) △H=-23.5kJmol-1
③CO(g)+H2O(g)![]() CO2(g)+H2(g) △H=-41.3kJmol-1
CO2(g)+H2(g) △H=-41.3kJmol-1
总合成反应的热化学方程式为__。
(3)一定条件下的密闭容器中,上述总反应达到平衡时,要提高CO的转化率,可以采取的措施是__(填字母代号)。
A.高温高压
B.加入催化剂
C.减少CO2的浓度
D.增加CO的浓度
E.分离出二甲醚
(4)已知反应②2CH3OH(g)![]() CH3OCH3(g)+H2O(g)在某温度下的平衡常数K=400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)在某温度下的平衡常数K=400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
c/molL-1 | 0.44 | 0.60 | 0.60 |
此时,v(正)__v(逆)(填“>”、“<”或“=”)。
【答案】0.225 molL-1min-1 放 5.33 减小 30% 3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g) △H=-246.4kJ/mol CE >
CH3OCH3(g)+CO2(g) △H=-246.4kJ/mol CE >
【解析】
(1)①分析图1,在10min时CO2、CH3OH的浓度不再发生变化,说明此时反应达到平衡状态,可先求出CO2的速率,根据同一反应中,各物质的速率之比等于其化学计量数之比,求出H2的速率。
②分析图2,在t2时,改变温度,v'正、v'逆突然增大,且v'正<v'逆,可知改变的条件为升高温度,此时反应向逆反应方向移动,据此分析反应是吸热还是放热反应。
(1)①由图可知,10min到达平衡时二氧化碳的浓度变化量为1.00mol/L-0.25mol/L=0.75mol/L,所以v(CO2)=![]() ,根据同一反应中,各物质的速率之比等于其化学计量数之比,可知v(H2)=3v(CO2)=3×0.075molL-1min-1=0.225 molL-1min-1,故答案为:0.225 molL-1min-1;
,根据同一反应中,各物质的速率之比等于其化学计量数之比,可知v(H2)=3v(CO2)=3×0.075molL-1min-1=0.225 molL-1min-1,故答案为:0.225 molL-1min-1;
②由图2可知,正、逆反应速率都增大,为升高温度,且逆反应速率增大更多,则反应向逆反应进行,故正反应为放热反应,故答案为:放;
③平衡时二氧化碳的浓度为0.25mol/L,则:

故500℃平衡常数K=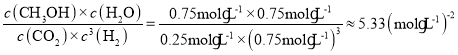 。
。
该反应正反应是放热反应,若提高温度,该反应向逆反应方向进行,达平衡时,K值减小。故答案为:5.33;减小;
④由③中计算可知,平衡时CH3OH的体积分数ω=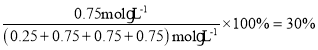 ,故答案为:30%;
,故答案为:30%;
Ⅱ(2)由盖斯定律可知,通过①×2+②+③可得3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g),则△H=-90.8kJmol-1×2-23.5kJmol-1-41.3kJmol-1=-246.4kJmol-1,故总合成反应的热化学方程式为:3H2(g)+3CO(g)
CH3OCH3(g)+CO2(g),则△H=-90.8kJmol-1×2-23.5kJmol-1-41.3kJmol-1=-246.4kJmol-1,故总合成反应的热化学方程式为:3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g)△H=-246.4kJ/mol,故答案为:3H2(g)+3CO(g)
CH3OCH3(g)+CO2(g)△H=-246.4kJ/mol,故答案为:3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g)△H=-246.4kJ/mol;
CH3OCH3(g)+CO2(g)△H=-246.4kJ/mol;
(3)A.由于反应放热,升高温度平衡向逆反应方向移动,CO转化率减小,A项错误;
B.催化剂不影响平衡移动,CO转化率不变,B项错误;
C.减少CO2的浓度,平衡向正反应方向移动,CO的转化率增大,C项正确;
D.增加CO的浓度,CO的转化率反而减小,D项错误;
E.分离出二甲醚,平衡向正反应方向移动,CO的转化率增大,E项正确;
故答案为CE;
(4)浓度商Qc=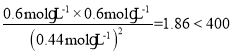 ,即Qc<K,故反应向正反应方向进行,则v(正)>v(逆)。故答案为:>。
,即Qc<K,故反应向正反应方向进行,则v(正)>v(逆)。故答案为:>。

【题目】按要求回答下列问题:
(1)以CO2和NH3为原料合成尿素是利用CO2的成功范例。在尿素合成塔中的主要反应可表示如下:
反应Ⅰ:2NH3(g)+CO2(g)![]() NH2COONH4(s) △H1
NH2COONH4(s) △H1
反应Ⅱ:NH2COONH4(s)![]() CO(NH2)2(s)+H2O(g) △H2= +72.49kJ/mol
CO(NH2)2(s)+H2O(g) △H2= +72.49kJ/mol
总反应:2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g) △H3= -86.98kJ/mol
CO(NH2)2(s)+H2O(g) △H3= -86.98kJ/mol
①反应Ⅰ的△H1=______________。
②一定温度下,在体积固定的密闭容器中按 n(NH3):n(CO2)=2:1 进行反应Ⅰ,下列能说明反应Ⅰ达到了平衡状态的是_______(填序号)。
A 容器内气体总压强不再变化
B NH3与CO2的转化率相等
C 容器内混合气体的密度不再变化
(2)在一定体积的密闭容器中进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如下表所示:
t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
①该反应的化学平衡常数表达式为K=___________。
②该反应为____________(填“吸热”或“放热”)反应。
③某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为________℃。
④在800 ℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)为2 mol·L-1,c(H2)为1.5 mol·L-1,c(CO)为1 mol·L-1,c(H2O)为3 mol·L-1,此时反应向________(填“正向”或“逆向”)进行。
(3)工业上从废铅蓄电池废液回收铅的过程中,常用纯碱溶液与处理后的铅膏(主要含PbSO4)发生反应:PbSO4(s)+CO32-(aq)![]() PbCO3(s)+SO42-(aq)。已知溶度积常数:Ksp(PbSO4)=1.6×10-8,Ksp(PbCO3)=7.4×10-14,则该反应的化学平衡常数K =____。
PbCO3(s)+SO42-(aq)。已知溶度积常数:Ksp(PbSO4)=1.6×10-8,Ksp(PbCO3)=7.4×10-14,则该反应的化学平衡常数K =____。