题目内容
【题目】在体积都为1L,pH都等于2的盐酸和醋酸溶液中,投入0.65g锌粒,则图所示比较符合客观事实的是
A.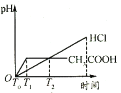 B.
B. C.
C. D.
D.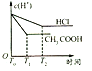
【答案】C
【解析】
1L、pH值等于2的盐酸溶液中c(H+)=0.01 molL1,n(H+)=0.01mol;1L、pH值等于2的醋酸溶液中存在电离平衡,平衡状态下氢离子浓度c(H+)=0.01 molL1,n(H+)=0.01mol,但溶液中醋酸的物质的量大于0.01mol;0.65g锌粒物质的量![]() ,锌和酸反应Zn+2H+=Zn2++H2↑,盐酸酸溶液中氢离子不足,锌剩余0.005mol;醋酸溶液中存在电离平衡,平衡状态下的氢离子不足,但随着反应进行,醋酸又电离出氢离子进行反应,放出的氢气一定比盐酸多,开始时由于氢离子浓度相同,开始的反应速率相同,反应过程中醋酸溶液中的氢离子浓度始终比盐酸溶液中的氢离子浓度大,所以反应速率快;反应后,醋酸有剩余,导致醋酸溶液中pH小于盐酸溶液中。
,锌和酸反应Zn+2H+=Zn2++H2↑,盐酸酸溶液中氢离子不足,锌剩余0.005mol;醋酸溶液中存在电离平衡,平衡状态下的氢离子不足,但随着反应进行,醋酸又电离出氢离子进行反应,放出的氢气一定比盐酸多,开始时由于氢离子浓度相同,开始的反应速率相同,反应过程中醋酸溶液中的氢离子浓度始终比盐酸溶液中的氢离子浓度大,所以反应速率快;反应后,醋酸有剩余,导致醋酸溶液中pH小于盐酸溶液中。
A. 已知开始时,溶液的pH值为2,图中开始时溶液的pH=0,故A错误;
B. 反应开始氢离子浓度相同,反应速率相同,曲线从相同速率开始反应,但醋酸溶液中存在电离平衡,反应过程中醋酸溶液中的氢离子浓度始终比盐酸溶液中的氢离子浓度大,所以醋酸溶液反应过程中反应速率快,故B错误;
C. 产生氢气的量从0开始逐渐增多,最终由于醋酸电离平衡的存在,生成氢气的量比盐酸多,反应过程中氢离子浓度大于盐酸溶液中氢离子浓度,和同量锌反应速率快,故图象符合题意,故C正确;
D. 反应开始氢离子浓度相同,反应过程中醋酸存在电离平衡,醋酸溶液中的氢离子浓度始终比盐酸溶液中的氢离子浓度大,故D错误。
综上所述,答案为C。

练习册系列答案
相关题目