题目内容
1.已知:常温下,Ka(HF)>Ka(HClO).现有1L 0.1mol•L-1的两种溶液:①NaClO溶液;②NaF溶液.下列说法正确的是( )| A. | c(H+):①>② | |
| B. | 分别加入1L 0.1mol•L-1HCl溶液后,两溶液的pH:①<② | |
| C. | 分别加入等浓度的盐酸至溶液呈中性,消耗盐酸的体积:①<② | |
| D. | n(HF)+n(F-)=n(HClO)+n(ClO-) |
分析 已知:常温下,Ka(HF)>Ka(HClO),则酸性:HF>HClO,
A.酸性越弱,对应的酸根离子的水解程度越大;
B.二者与HCl反应均生成弱酸;
C.溶液的碱性越强消耗的盐酸越多;
D.根据物料守恒分析.
解答 解:已知:常温下,Ka(HF)>Ka(HClO),则酸性:HF>HClO,
A.酸性越弱,对应的酸根离子的水解程度越大,所以NaClO的水解程度大,则NaClO溶液中氢氧根离子浓度大,氢离子浓度小,即c(H+):①<②,故A错误;
B.与盐酸恰好完全反应后所得溶液为氯化钠和弱酸,HClO的酸性小于HF,溶液的pH:①>②,故B错误;
C.溶液的碱性越强消耗的盐酸越多,溶液中c(OH-):①>②,故加入盐酸至中性所消耗盐酸体积:①>②,故C错误;
D.NaClO和NaF的物质的量相同,根据物料守恒可知n(HF)+n(F-)=n(HClO)+n(ClO-),故D正确.
故选D.
点评 本题考查电解质的强弱与电离常数的关系,题目难度中等,试题侧重于学生的分析能力和计算能力的考查,明确酸的电离常数与酸的强弱、酸根离子水解能力的关系是解本题关键.

练习册系列答案
相关题目
11.下列离子方程式书写正确的是( )
| A. | KMnO4溶液用盐酸酸化并加入H2O2:2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O | |
| B. | Fe2(SO4)3和Ba(OH)2溶液混合:Fe3++SO42-+Ba2++3OH-=BaSO4↓+Fe(OH)3↓ | |
| C. | 等体积等物质的量浓度的AlCl3、Ba(OH)2、HCl溶液混合:3H++Al3++6OH-=Al(OH)3↓+3H2O | |
| D. | 水玻璃与稀醋酸混合:SiO32-+2H+=H2SiO3↓ |
12.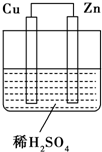 如图所示是Zn和Cu形成的原电池,其实验兴趣小组做完实验后,在读书卡上的记录如下,则卡片上的描述合理的是( )
如图所示是Zn和Cu形成的原电池,其实验兴趣小组做完实验后,在读书卡上的记录如下,则卡片上的描述合理的是( )
试验后的记录:
①Cu为负极,Zn为正极
②Cu极上有气泡产生
③SO42-向Cu移动
④若有0.5mol电子流经导线,则可产生0.25mol气体
⑤电子的流向是:Cu→Zn
⑥正极反应式:Cu-2e-=Cu2+.
 如图所示是Zn和Cu形成的原电池,其实验兴趣小组做完实验后,在读书卡上的记录如下,则卡片上的描述合理的是( )
如图所示是Zn和Cu形成的原电池,其实验兴趣小组做完实验后,在读书卡上的记录如下,则卡片上的描述合理的是( )试验后的记录:
①Cu为负极,Zn为正极
②Cu极上有气泡产生
③SO42-向Cu移动
④若有0.5mol电子流经导线,则可产生0.25mol气体
⑤电子的流向是:Cu→Zn
⑥正极反应式:Cu-2e-=Cu2+.
| A. | ①②③ | B. | ②④ | C. | ④⑤⑥ | D. | ③④⑤ |
16.苯环上连有-C4H9和-C3H7两个取代基,若不考虑立体异构,这类物质的结构共有( )
| A. | 6种 | B. | 18种 | C. | 24种 | D. | 48种 |
6.4价铅具有强氧化性,能氧化浓盐酸生成氯气,+2价铅稳定.四氧化三铅可以看成是由PbO和PbO2组成.现有PbO2和Pb3O4组成的混合物平分成两份:一份混合物在加热条件下用足量一氧化碳还原,将气体产物通入足量澄清石灰水中,过滤、洗涤、干燥,得到4.0g固体.另一份混合物与足量的浓盐酸完全反应,在标准状况下产生氯气体积可能是( )
| A. | 224 mL | B. | 336 mL | C. | 448 mL | D. | 672 mL |
13.化学在生产和生活中有重要的应用,下列说法不正确的是( )
| A. | 可溶性铁盐、铝盐均可用于水的净化 | |
| B. | “开发利用新能源”、“汽车尾气催化净化”都能提高空气质量 | |
| C. | 电解NaCl溶液可制得金属钠 | |
| D. | 在海轮外壳上镶嵌上锌块,可减缓船体的腐蚀速率 |
10.下列叙述不正确的是( )
| A. | 1个丙烯分子有8个σ键,1个π键 | |
| B. | 1、4-二甲苯核磁共振氢谱中有两组峰,且氢原子数之比为3:2 | |
| C. | 丙氨酸分子属于手性分子 | |
| D. | 分子式为C2H6O的红外光谱图上发现有C-H键和C-O键的振动吸收,由此可以初步推测有机物结构简式为C2H5-OH |
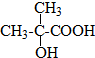 B的结构简式
B的结构简式 .
.
 H++H2PO4-、H2PO4-
H++H2PO4-、H2PO4-