题目内容
10.下列叙述不正确的是( )| A. | 1个丙烯分子有8个σ键,1个π键 | |
| B. | 1、4-二甲苯核磁共振氢谱中有两组峰,且氢原子数之比为3:2 | |
| C. | 丙氨酸分子属于手性分子 | |
| D. | 分子式为C2H6O的红外光谱图上发现有C-H键和C-O键的振动吸收,由此可以初步推测有机物结构简式为C2H5-OH |
分析 A.C-C、C-H键均为σ键,C=C中一个σ键,一个π键;
B.有机物结构简式中位置相同的氢原子,其核磁共振氢谱的峰相同;
C.手性碳原子判断注意:(1)手性碳原子一定是饱和碳原子;(2)手性碳原子所连接的四个基团要是不同的,然后根据手性分子是含有手性碳原子的分子;
D.二甲醚CH3-O-CH3中也含有C-H键和C-O键.
解答 解:A.C-C、C-H键均为σ键,C=C中一个σ键,一个π键,则丙烯分子有8个σ键,1个π键,故A正确;
B.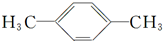 为对二甲苯,两个甲基中的氢原子位置相同,苯环上的4个氢原子位置相同,所以其核磁共振氢谱会出现两组峰,其氢原子数之比为6:4=3:2,故B正确;
为对二甲苯,两个甲基中的氢原子位置相同,苯环上的4个氢原子位置相同,所以其核磁共振氢谱会出现两组峰,其氢原子数之比为6:4=3:2,故B正确;
C.丙氨酸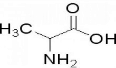 中一个碳原子所连接的四个基团有甲基、氨基、氢原子和羧基,是手性碳原子,属于手性分子,故C正确;
中一个碳原子所连接的四个基团有甲基、氨基、氢原子和羧基,是手性碳原子,属于手性分子,故C正确;
D.分子式为C2H6O的红外光谱图上发现有C-H键和C-O键的振动吸收,由于二甲醚CH3-O-CH3中也含有C-H键和C-O键,无法判断该有机物是否为乙醇,故D错误.
故选D.
点评 本题考查共价键及分类手性分子等,注意判断共价键的规律和常见有机物的空间结构来解答,手性碳的判断为解答的易错点,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.元素在周期表中的位置,反映了元素的原子结构和元素的性质,下列说法正确的是( )
| A. | 短周期元素形成离子后,最外层电子达到都达到8电子稳定结构 | |
| B. | 所有主族元素的正化合价数等于它的族序数 | |
| C. | 第3、4、5、6周期元素的数目分别是8、18、32、32 | |
| D. | 第4周期由左至右第8、9、10三列中没有非金属元素 |
1.已知:常温下,Ka(HF)>Ka(HClO).现有1L 0.1mol•L-1的两种溶液:①NaClO溶液;②NaF溶液.下列说法正确的是( )
| A. | c(H+):①>② | |
| B. | 分别加入1L 0.1mol•L-1HCl溶液后,两溶液的pH:①<② | |
| C. | 分别加入等浓度的盐酸至溶液呈中性,消耗盐酸的体积:①<② | |
| D. | n(HF)+n(F-)=n(HClO)+n(ClO-) |
18.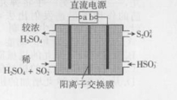 利用如图所示装置(电极均为惰性电极)可吸收SO2,并用阴极排出的溶液吸收NO2,下列叙述错误的是( )
利用如图所示装置(电极均为惰性电极)可吸收SO2,并用阴极排出的溶液吸收NO2,下列叙述错误的是( )
 利用如图所示装置(电极均为惰性电极)可吸收SO2,并用阴极排出的溶液吸收NO2,下列叙述错误的是( )
利用如图所示装置(电极均为惰性电极)可吸收SO2,并用阴极排出的溶液吸收NO2,下列叙述错误的是( )| A. | a为直流电源的正极 | |
| B. | 阴极的电极反应式为:2HSO3-+e-=S2O42-+H2O | |
| C. | 阳极的电极反应式为:SO2+2H2O-2e-=SO42-+4H+ | |
| D. | 电解时,H+由阳极室通过阳离子交换膜到达阴极室 |
2.关于如图所示装置(假设溶液体积不变),下列叙述正确的是( )
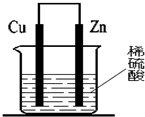

| A. | 电子从大量产生气泡的一极流出 | |
| B. | 反应一段时间后,溶液逐渐变为蓝色 | |
| C. | 逐渐溶解的一极上发生还原反应 | |
| D. | 烧杯内溶液中阳离子的物质的量浓度总和逐渐减小 |
19.下列实验不能达到目的是( )
| A. | 用KSCN溶液检验Fe2+ | B. | 用湿润的红色石蕊试纸检验氨气 | ||
| C. | 用湿润的淀粉碘化钾试纸检验氯气 | D. | 用硝酸酸化的AgNO3溶液检验Cl- |
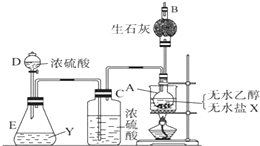 为证明乙醇分子中含有氧原子,现采用一套装置进行实验.试根据装置示意图、试剂及实验现象,回答有关问题.
为证明乙醇分子中含有氧原子,现采用一套装置进行实验.试根据装置示意图、试剂及实验现象,回答有关问题.