题目内容
6.4价铅具有强氧化性,能氧化浓盐酸生成氯气,+2价铅稳定.四氧化三铅可以看成是由PbO和PbO2组成.现有PbO2和Pb3O4组成的混合物平分成两份:一份混合物在加热条件下用足量一氧化碳还原,将气体产物通入足量澄清石灰水中,过滤、洗涤、干燥,得到4.0g固体.另一份混合物与足量的浓盐酸完全反应,在标准状况下产生氯气体积可能是( )| A. | 224 mL | B. | 336 mL | C. | 448 mL | D. | 672 mL |
分析 依据碳酸钙的质量计算碳酸钙的物质的量,依据CO→CO2→CaCO3知,混合物中含氧原子的物质的量为n(O)=0.04 mol.采用极端假设法计算解答.
解答 解:PbO和PbO2都能与CO反应生成二氧化碳,依据CO→CO2→CaCO3,n(CaCO3)=$\frac{4.0g}{100g•mol-1}$=0.04 mol,所以消耗CO的物质的量为0.04mol,由PbO~CO,PbO2~2CO可知:混合物中含氧原子的物质的量为n(O)=0.04 mol,
若固体全部为二氧化铅,则二氧化铅的物质的量为0.02 mol,发生反应PbO2+4HCl=PbCl2+Cl2↑+2H2O,
PbO2~Cl2↑
1 1
0.02mol 0.02mol
标况下气体体积为:0.02mol×22.4L/mol=0.448L=448ml;
若固体为四氧化三铅,则四氧化三铅的物质的量为0.01mol,发生反应Pb3O4+8HCl=3PbCl2+Cl2↑+4H2O,
Pb3O4~Cl2↑
1 1
0.01mol 0.01mol
标况下气体体积为:0.01mol×22.4L/mol=0.224L=224ml;
固体为PbO2和Pb3O4组成的混合物,所以产生气体体积为:224 mL<V(Cl2)<448 mL,
故选:B.
点评 本题考查了有关方程式的计算,明确发生的反应及各种物质之间量的关系,利用极值法即可解答,题目难度中等.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
17.下列有关晶体的说法中正确的是( )
| A. | 氯化钾溶于水时离子键未被破坏 | B. | 原子晶体中共价键越强,熔点越高 | ||
| C. | 冰融化时分子中共价键发生断裂 | D. | 分子间作用力越大,分子越稳定 |
14.下列有关实验的说法正确的是( )
| A. | 用湿润的pH试纸测溶液的pH | |
| B. | 实验室制备干燥纯净的氯气时,气体先通过饱和食盐水再通过浓硫酸 | |
| C. | 用玻璃棒在过滤器上搅拌以加速AgCl沉淀的洗涤 | |
| D. | 中和滴定实验中,锥形瓶用蒸馏水洗净后未干燥,测定结果偏低 |
1.已知:常温下,Ka(HF)>Ka(HClO).现有1L 0.1mol•L-1的两种溶液:①NaClO溶液;②NaF溶液.下列说法正确的是( )
| A. | c(H+):①>② | |
| B. | 分别加入1L 0.1mol•L-1HCl溶液后,两溶液的pH:①<② | |
| C. | 分别加入等浓度的盐酸至溶液呈中性,消耗盐酸的体积:①<② | |
| D. | n(HF)+n(F-)=n(HClO)+n(ClO-) |
18.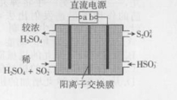 利用如图所示装置(电极均为惰性电极)可吸收SO2,并用阴极排出的溶液吸收NO2,下列叙述错误的是( )
利用如图所示装置(电极均为惰性电极)可吸收SO2,并用阴极排出的溶液吸收NO2,下列叙述错误的是( )
 利用如图所示装置(电极均为惰性电极)可吸收SO2,并用阴极排出的溶液吸收NO2,下列叙述错误的是( )
利用如图所示装置(电极均为惰性电极)可吸收SO2,并用阴极排出的溶液吸收NO2,下列叙述错误的是( )| A. | a为直流电源的正极 | |
| B. | 阴极的电极反应式为:2HSO3-+e-=S2O42-+H2O | |
| C. | 阳极的电极反应式为:SO2+2H2O-2e-=SO42-+4H+ | |
| D. | 电解时,H+由阳极室通过阳离子交换膜到达阴极室 |
16.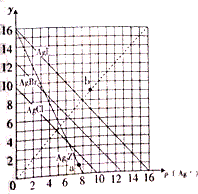 卤化银AgX及Ag2Z的沉淀溶解平衡曲线如图所示,已知横坐标p(Ag+)=-lgc(Ag+),纵坐标y=-lgc(X-)或-lgc(Z2-).下列说法正确的是( )
卤化银AgX及Ag2Z的沉淀溶解平衡曲线如图所示,已知横坐标p(Ag+)=-lgc(Ag+),纵坐标y=-lgc(X-)或-lgc(Z2-).下列说法正确的是( )
 卤化银AgX及Ag2Z的沉淀溶解平衡曲线如图所示,已知横坐标p(Ag+)=-lgc(Ag+),纵坐标y=-lgc(X-)或-lgc(Z2-).下列说法正确的是( )
卤化银AgX及Ag2Z的沉淀溶解平衡曲线如图所示,已知横坐标p(Ag+)=-lgc(Ag+),纵坐标y=-lgc(X-)或-lgc(Z2-).下列说法正确的是( )| A. | 该温度下Ag2Z的Ksp约为1×10-8 | |
| B. | a点可表示AgCl的过饱和溶液 | |
| C. | b点可表示AgI的过饱和溶液,且c(Ag+)=c(I-) | |
| D. | 该温度下AgCl、AgBr形成的混合溶液的饱和溶液中:c(Cl-)<c(Br-) |
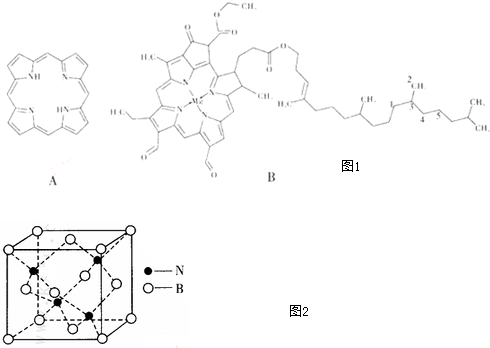
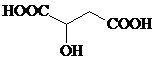 $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$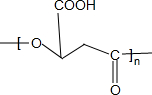 +nH2O;
+nH2O;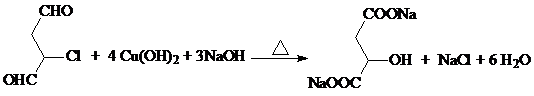 +2Cu2O↓.
+2Cu2O↓.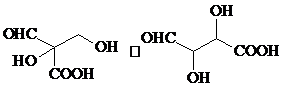 .
.