题目内容
16.苯环上连有-C4H9和-C3H7两个取代基,若不考虑立体异构,这类物质的结构共有( )| A. | 6种 | B. | 18种 | C. | 24种 | D. | 48种 |
分析 考虑-C4H9有4种和-C3H7有2种异构体以及取代基的位置(苯环上取代:邻、间、对),据此判断异构体的种类即可.
解答 解:-C4H9有四种结构,分别为:CH3-CH2-CH2-CH2-、CH3-CH2-CH(CH3)-、(CH3)2CH-CH2-、(CH3)3C-,-C3H7有两种结构,分别为:CH3-CH2-CH2-、CH3-CH(CH3)-,两种取代基可处于邻、间、对三种位置,所以有机物共有同分异构体4×2×3=24,故选C.
点评 本题主要考查了同分异构体的书写,中等难度,解题关键要搞清取代基的异构体及数学组合法的运用,熟练记忆碳原子数小于5的取代基的个数可以简化分析.

练习册系列答案
相关题目
6.下列叙述正确的是( )
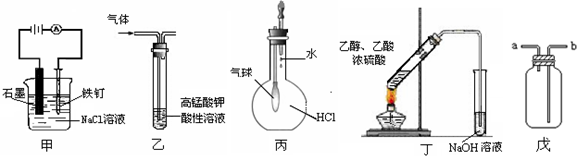
①装置甲可防止铁钉生锈
②装置乙可除去乙烯中混有的乙炔
③装置丙可验证HCl气体在水中的溶解性
④装置丁可用于实验室制取乙酸乙酯
⑤装置戊可用于收集H2、CO2、Cl2、HCl、NO2等气体.

①装置甲可防止铁钉生锈
②装置乙可除去乙烯中混有的乙炔
③装置丙可验证HCl气体在水中的溶解性
④装置丁可用于实验室制取乙酸乙酯
⑤装置戊可用于收集H2、CO2、Cl2、HCl、NO2等气体.
| A. | ①⑤ | B. | ②④ | C. | ③④ | D. | ③⑤ |
7.下列物质中,只含有离子键的是( )
| A. | NaOH | B. | NH4Cl | C. | MgCl2 | D. | H2O |
4.将 转变为
转变为 的方法为( )
的方法为( )
 转变为
转变为 的方法为( )
的方法为( )| A. | 与稀H2SO4共热后,加入足量的NaOH | |
| B. | 加入足量的稀盐酸共热 | |
| C. | 与稀H2SO4共热后,加入足量的NaHCO3 | |
| D. | 与足量的NaOH溶液共热后,再滴加过量的盐酸 |
11.下列有机反应属于加成反应的是( )
| A. | CH2=CH-CH3+Cl2$\stackrel{高温}{→}$CH2=CHCH2Cl+HCl | |
| B. | 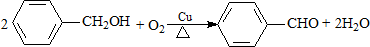 | |
| C. | 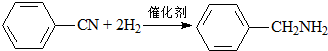 | |
| D. | 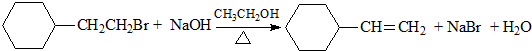 |
1.已知:常温下,Ka(HF)>Ka(HClO).现有1L 0.1mol•L-1的两种溶液:①NaClO溶液;②NaF溶液.下列说法正确的是( )
| A. | c(H+):①>② | |
| B. | 分别加入1L 0.1mol•L-1HCl溶液后,两溶液的pH:①<② | |
| C. | 分别加入等浓度的盐酸至溶液呈中性,消耗盐酸的体积:①<② | |
| D. | n(HF)+n(F-)=n(HClO)+n(ClO-) |
8.碳及其化合物有广泛应用.
(1)工业冶炼铝,以石墨为阳极.阳极反应式为2O2--4e-=O2↑,可能发生副反应有C+O2$\frac{\underline{\;高温\;}}{\;}$CO2(或2C+O2$\frac{\underline{\;高温\;}}{\;}$2CO).
(2)一氧化碳和空气在酸性介质中构成燃料电池,负极反应式为.如果理论输出电压为1.50V,能量密度E=.
(3)向75mL 4mol•L-1KOH溶液中缓慢通入4480mL CO2气体(标准状况)恰好完全被吸收.①写出该反应的离子方程式:2CO2+3OH-=CO32-+HCO3-+H2O.
②该吸收溶液中离子浓度大小排序为c(K+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
③常温下,a mol•L-1KHCO3溶液的pH=8,HCO3-的水解常数约等于$\frac{10{\;}^{-12}}{a-10{\;}^{-6}}$.(用含a式表示).
(4)已知:①2H2(g)+O2(g)=2H2O(l)△H1=-571.6kJ•mol-1
②2CO(g)+O2(g)=2CO2(g)△H2=-566.0kJ•mol-1
③CO(g)+2H2(g)═CH3OH(g)△H3=-90.8kJ•mol-1
计算甲醇蒸气的燃烧热△H=-763.8kJ•mol-1.
(5)某温度下,发生可逆反应:CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41.0kJ•mol-1
①向某容器中充入1.0molH2和1.0mol(g),在一定条件下发生上述反应.混合气体中CO的物质的量与时间关系如下列所示:
相对实验I,实验II可能改变的条件可能是,该温度下,平衡常数=1.
②若开始向绝热容器中投入一定量二氧化碳、氢气在一定条件下发生上述可逆反应.
下列图象正确且说明可逆反应达到平衡状态的是A.(填序号)
(1)工业冶炼铝,以石墨为阳极.阳极反应式为2O2--4e-=O2↑,可能发生副反应有C+O2$\frac{\underline{\;高温\;}}{\;}$CO2(或2C+O2$\frac{\underline{\;高温\;}}{\;}$2CO).
(2)一氧化碳和空气在酸性介质中构成燃料电池,负极反应式为.如果理论输出电压为1.50V,能量密度E=.
(3)向75mL 4mol•L-1KOH溶液中缓慢通入4480mL CO2气体(标准状况)恰好完全被吸收.①写出该反应的离子方程式:2CO2+3OH-=CO32-+HCO3-+H2O.
②该吸收溶液中离子浓度大小排序为c(K+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
③常温下,a mol•L-1KHCO3溶液的pH=8,HCO3-的水解常数约等于$\frac{10{\;}^{-12}}{a-10{\;}^{-6}}$.(用含a式表示).
(4)已知:①2H2(g)+O2(g)=2H2O(l)△H1=-571.6kJ•mol-1
②2CO(g)+O2(g)=2CO2(g)△H2=-566.0kJ•mol-1
③CO(g)+2H2(g)═CH3OH(g)△H3=-90.8kJ•mol-1
计算甲醇蒸气的燃烧热△H=-763.8kJ•mol-1.
(5)某温度下,发生可逆反应:CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41.0kJ•mol-1
①向某容器中充入1.0molH2和1.0mol(g),在一定条件下发生上述反应.混合气体中CO的物质的量与时间关系如下列所示:
| 0 | 5min | 10min | 15min | 20min | 25min | |
| I(800℃) | 1.0 | 0.80 | 0.70 | 0.65 | 0.50 | 0.50 |
| Ⅱ(800℃) | 1.0 | 0.7 | 0.60 | 0.50 | 0.50 | 0.50 |
②若开始向绝热容器中投入一定量二氧化碳、氢气在一定条件下发生上述可逆反应.
下列图象正确且说明可逆反应达到平衡状态的是A.(填序号)

6.甲醇是一种重要的化工原料,广泛应用于化工生产,也可以直接用作燃料.已知:CH3OH(l)+O2(g)=CO(g)+2H2O(g)△H1=-443.64kJ•mol-12CO(g)+O2(g)=2CO2(g)△H2=-566.0kJ•mol-1下列说法或热化学方程式正确的是( )
| A. | CO的燃烧热为566.0 kJ•mol-1 | |
| B. | 2 mol CO和1 mol O2的总能量比2 mol CO2的总能量低 | |
| C. | 完全燃烧20g甲醇,生成二氧化碳和水蒸气时放出的热量为908.3 kJ | |
| D. | 2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1453.28 kJ•mol-1 |
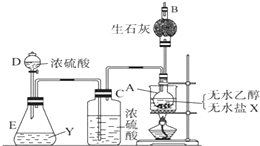 为证明乙醇分子中含有氧原子,现采用一套装置进行实验.试根据装置示意图、试剂及实验现象,回答有关问题.
为证明乙醇分子中含有氧原子,现采用一套装置进行实验.试根据装置示意图、试剂及实验现象,回答有关问题.