题目内容
12.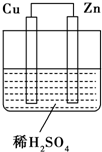 如图所示是Zn和Cu形成的原电池,其实验兴趣小组做完实验后,在读书卡上的记录如下,则卡片上的描述合理的是( )
如图所示是Zn和Cu形成的原电池,其实验兴趣小组做完实验后,在读书卡上的记录如下,则卡片上的描述合理的是( )试验后的记录:
①Cu为负极,Zn为正极
②Cu极上有气泡产生
③SO42-向Cu移动
④若有0.5mol电子流经导线,则可产生0.25mol气体
⑤电子的流向是:Cu→Zn
⑥正极反应式:Cu-2e-=Cu2+.
| A. | ①②③ | B. | ②④ | C. | ④⑤⑥ | D. | ③④⑤ |
分析 如图所示Zn和Cu形成的原电池中,Zn为负极,失电子发生氧化反应,Cu为正极,氢离子在正极上得电子发生还原反应,电子从负极经外电路流向正极,据此分析.
解答 解:①在该原电池中,活泼金属锌做负极,金属铜做正极,故①错误;
②根据金属活动性顺序知,锌作负极,铜作正极,氢离子在铜电极上得电子生成氢气,发生还原反应,所以在铜极上有气泡产生,发生还原反应,故②正确;
③锌失去电子变成金属阳离子进入溶液,所以在锌极附近有带正电荷的离子,根据异性电荷相吸原理,硫酸根离子向锌极移动,故③错误;
④根据电极反应式:2H++2e-=H2↑
2mol 1mol
0.5mol0.25mol
故④正确;
⑤外电路电子流向为从负极到正极,即Zn→Cu,故⑤错误;
⑥正极上氢离子得电子生成氢气,所以其反应式为 2H++2e-=H 2↑,故⑥错误.
故选B.
点评 本题考查了原电池中电极判断和电极反应以及电子流向和计算,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.下列措施对增大反应速率明显有效的是( )
| A. | 在K2SO4与BaCl2两溶液反应时,增大压强 | |
| B. | Fe与稀硫酸反应制取H2时,改用浓硫酸 | |
| C. | Al在氧气中燃烧生成A12O3,将Al片改成Al粉 | |
| D. | Na与水反应时增大水的用量 |
20.元素在周期表中的位置,反映了元素的原子结构和元素的性质,下列说法正确的是( )
| A. | 短周期元素形成离子后,最外层电子达到都达到8电子稳定结构 | |
| B. | 所有主族元素的正化合价数等于它的族序数 | |
| C. | 第3、4、5、6周期元素的数目分别是8、18、32、32 | |
| D. | 第4周期由左至右第8、9、10三列中没有非金属元素 |
7.下列物质中,只含有离子键的是( )
| A. | NaOH | B. | NH4Cl | C. | MgCl2 | D. | H2O |
17.下列有关晶体的说法中正确的是( )
| A. | 氯化钾溶于水时离子键未被破坏 | B. | 原子晶体中共价键越强,熔点越高 | ||
| C. | 冰融化时分子中共价键发生断裂 | D. | 分子间作用力越大,分子越稳定 |
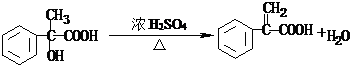
4.将 转变为
转变为 的方法为( )
的方法为( )
 转变为
转变为 的方法为( )
的方法为( )| A. | 与稀H2SO4共热后,加入足量的NaOH | |
| B. | 加入足量的稀盐酸共热 | |
| C. | 与稀H2SO4共热后,加入足量的NaHCO3 | |
| D. | 与足量的NaOH溶液共热后,再滴加过量的盐酸 |
1.已知:常温下,Ka(HF)>Ka(HClO).现有1L 0.1mol•L-1的两种溶液:①NaClO溶液;②NaF溶液.下列说法正确的是( )
| A. | c(H+):①>② | |
| B. | 分别加入1L 0.1mol•L-1HCl溶液后,两溶液的pH:①<② | |
| C. | 分别加入等浓度的盐酸至溶液呈中性,消耗盐酸的体积:①<② | |
| D. | n(HF)+n(F-)=n(HClO)+n(ClO-) |
2.关于如图所示装置(假设溶液体积不变),下列叙述正确的是( )
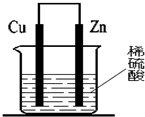

| A. | 电子从大量产生气泡的一极流出 | |
| B. | 反应一段时间后,溶液逐渐变为蓝色 | |
| C. | 逐渐溶解的一极上发生还原反应 | |
| D. | 烧杯内溶液中阳离子的物质的量浓度总和逐渐减小 |
 .
. .
. .
.