题目内容
15.聚酯纤维在室内装修等领域中有着广泛的应用.合成某种聚酯纤维H的流程图如图所示: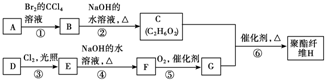
已知:A、D为烃,质谱图表明G的相对分子质量为166,其中含碳57.8%,含氢3.6%,其余为氧;G能与NaHCO3溶液反应且含有苯环;核磁共振氢谱表明E、G分子中均有两种类型的氢原子,且E分子中两种类型的氢原子的个数之比为1:1.
(1)①③的反应类型依次为加成反应、取代反应.
(2)B的名称为1,2-二溴乙烷;E的结构简式为
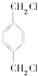 .
.(3)写出下列化学反应方程式:
②BrCH2CH2Br+2NaOH$→_{△}^{水}$HOCH2CH2OH+2NaBr;⑥
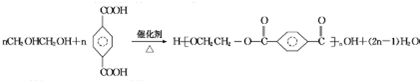 .
.(4)F有多种同分异构体,写出同时符合下列条件的所有同分异构体的结构简式:
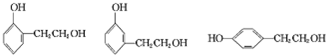 .
.a.含有苯环且苯环上只有2个取代基;
b.能与NaOH溶液反应;
c.在Cu催化下与O2反应的产物能发生银镜反应.
分析 烃A和溴发生加成反应生成B,B和氢氧化钠的水溶液发生取代反应生成C,根据C的分子式知,C是HOCH2CH2OH,则B是BrCH2CH2Br,A是乙烯.D为烃,质谱图表明G的相对分子质量为166,其中含碳元素57.8%,含氢元素3.6%,其余为氧元素,则D分子中碳原子个数为$\frac{166×57.8%}{12}$=8,H原子数目为$\frac{166×3.6%}{1}$=6,O原子数目为$\frac{166-12×8-6}{16}$=4,故G的分子式为C8H6O4,G能与NaHCO3溶液反应,说明G中含有羧基,G分子中含有两种类型的氢原子,且G中含有苯环,则G的结构简式为: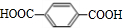 ,由转化关系可知,F为
,由转化关系可知,F为 ,E的结构简式为:
,E的结构简式为: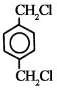 ,D为
,D为 ,乙二醇和对二苯甲酸反应生成聚酯纤维H为
,乙二醇和对二苯甲酸反应生成聚酯纤维H为 ,据此解答.
,据此解答.
解答 解:烃A和溴发生加成反应生成B,B和氢氧化钠的水溶液发生取代反应生成C,根据C的分子式知,C是HOCH2CH2OH,则B是BrCH2CH2Br,A是乙烯.D为烃,质谱图表明G的相对分子质量为166,其中含碳元素57.8%,含氢元素3.6%,其余为氧元素,则D分子中碳原子个数为$\frac{166×57.8%}{12}$=8,H原子数目为$\frac{166×3.6%}{1}$=6,O原子数目为$\frac{166-12×8-6}{16}$=4,故G的分子式为C8H6O4,G能与NaHCO3溶液反应,说明G中含有羧基,G分子中含有两种类型的氢原子,且G中含有苯环,则G的结构简式为: ,由转化关系可知,F为
,由转化关系可知,F为 ,E的结构简式为:
,E的结构简式为: ,D为
,D为 ,乙二醇和对二苯甲酸反应生成聚酯纤维H为
,乙二醇和对二苯甲酸反应生成聚酯纤维H为 .
.
(1)反应①属于加成反应,反应③属于取代反应,故答案为:加成反应;取代反应;
(2)由上述分析可知,B是BrCH2CH2Br,名称为1,2-二溴乙烷,E的结构简式为 ,
,
故答案为:1,2-二溴乙烷; ;
;
(4)反应②的化学反应方程式为:BrCH2CH2Br+2NaOH$→_{△}^{水}$HOCH2CH2OH+2NaBr;
反应⑥的化学反应方程式为: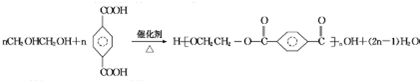 ,
,
故答案为:BrCH2CH2Br+2NaOH$→_{△}^{水}$HOCH2CH2OH+2NaBr;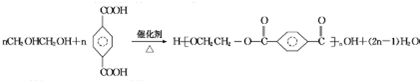 ;
;
(5)F( )有多种同分异构体,同时符合下列条件的同分异构体:
)有多种同分异构体,同时符合下列条件的同分异构体:
a.含有苯环且苯环上只有2个取代基,b.能与NaOH溶液反应,含有酚羟基,c.在Cu催化下与O2反应的产物能发生银镜反应,含有醇羟基,符合条件的同分异构体有: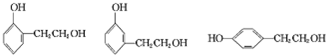 ,
,
故答案为: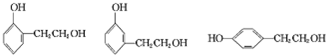 .
.
点评 本题考查有机物的推断、有机反应类型、同分异构体书写等,注意根据反应条件及有机物分子式进行推断,需要学生熟练掌握官能团的性质与转化,难度中等.

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案| A. | NH4Cl | B. | NaF | C. | KOH | D. | H2SO4 |
| A. | 将高锰酸钾晶体加热分解,所得固体质量减少 | |
| B. | 观察氯化钾溶液没有颜色,表明溶液中K+无色 | |
| C. | 在氯化钾溶液中加入适量锌粉振荡,静置后未见明显变化,表明锌与K+无反应 | |
| D. | 在高锰酸钾溶液中加入适量锌粉振荡,静置后见紫红色褪去,表明MnO4-离子为紫红色 |
| A. | NH4+ | B. | Ca2+ | C. | Mg2+ | D. | Al3+ |
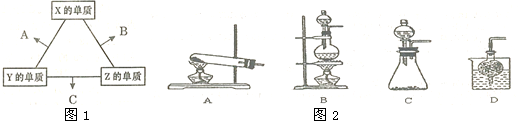
(1)由 X、Y、Z三种元素共同组成的三种不同种类的常见化合物的化学式为NH4NO3、NH3•H2O、HNO3,相同浓度上述水溶液中由水电离出的c(H+)最小的是HNO3(填写化学式).
(2)Allis-Chalmers制造公司发现可以用C作为燃料电池的燃料,以氢氧化钾溶液为介质,反应生成对环境无污染的常见物质,试写出该电池负极的电极反应式4NH3+12OH--12e-=2N2+12H2O,溶液中OH-向负极移动(填“正”或“负”).
(3)Z分别与X、Y两元素可以构成18个电子分子甲和乙,其分子中只存在共价单键,常温下甲、乙均为无色液体,甲随着温度升高分解速率加快.
①乙能够将CuO还原为Cu2O,已知每lmol乙参加反应有4mole-转移,该反应的化学方程式为N2H4+4CuO=N2↑+2Cu2O+2H2O.
②将铜粉末用10%甲和3.0mol•L-1H2SO4混合溶液处埋,测得不同温度下铜的平均溶解速率如下表:
| 温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 铜的平均溶解速率 (×10-3mol•L-1•min-1) | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
③实验室可用甲作试剂取X的单质,发生装置可选用图2中的C(填装置代号).
| A. | pH均为9的①Na2CO3溶液、②CH3COONa溶液、③NaOH溶液,其物质的量浓度的大小顺序为①>②>③ | |
| B. | 等物质的量浓度的Na2CO3溶液和NaHCO3溶液等体积混合,所得溶液中:c(CO32-)+c(OH-)<c(H+)+c(HCO3-)+3c(H2CO3) | |
| C. | 0.1 mol•L-1KHC2O4溶液中:c(OH-)=c(H+)+c(H2C2O4)-2c(C2O42-) | |
| D. | pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合液的pH等于7,则反应后的混合液:c(R2-)+c(HR-)=c(Na+) |
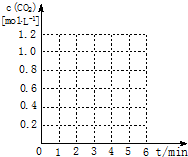 某化学兴趣小组对碳的氧化物做了深入的研究并取得了一些成果.
某化学兴趣小组对碳的氧化物做了深入的研究并取得了一些成果.已知:C(s)+O2(g)?CO2(g)△H=-393kJ•mol-1;
2CO (g)+O2(g)?2CO2(g)△H=-566kJ•mol-1;
2H2(g)+O2(g)?2H2O(g)△H=-484kJ•mol-1
(1)将水蒸气喷到灼热的炭上实现炭的气化(制得CO、H2),该反应的热化学方程式为C(s)+H2O(g)=CO (g)+H2(g)△H=+132 kJ•mol-1.
(2)将一定量CO(g)和H2O(g)分别通入容积为1L的恒容密闭容器中,发生反应:
CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
| 实验组序 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| H2O | CO | CO2 | |||
| 1 | 500 | 4 | 8 | 3.2 | 4 |
| 2 | 750 | 2 | 4 | 0.8 | 3 |
| 3 | 750 | 2 | 4 | 0.8 | 1 |
②实验1中,0~4min时段内,以v(H2)表示的反应速率为0.8mol/(L•min).
③实验2达到平衡时CO的转化率为20%.
④实验3与实验2相比,改变的条件是加催化剂;
请在如图坐标中画出“实验2”与“实验3”中c(CO2)随时间变化的曲线,并作必要的标注.
(3)在载人航天器中应用电化学原理,以Pt为阳极,Pb(CO2的载体)为阴极,KHCO3溶液为电解质溶液,
还原消除航天器内CO2同时产生O2和新的能源CO,总反应的化学方程式为:2CO2 $\frac{\underline{\;通电\;}}{\;}$2CO+O2,若阳
极为溶液中的OH-放电,则阳极的电极反应式为4OH--4e-=O2↑+2H2O.
(4)将CO通入银氨溶液中可析出黑色的金属颗粒,其反应方程式为CO+2Ag(NH3)2OH=2Ag↓+(NH4)2CO3+2NH3.
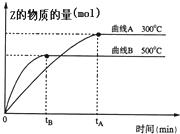 向a L密闭容器中加入1mol X气体和2mol Y气体,发生如下反应:X(g)+2Y(g)?2Z(g),不同温度下,测得平衡状态Z的物质的量变化曲线如图所示.
向a L密闭容器中加入1mol X气体和2mol Y气体,发生如下反应:X(g)+2Y(g)?2Z(g),不同温度下,测得平衡状态Z的物质的量变化曲线如图所示.