题目内容
15.下列对于NaCl的正确叙述是( )| A. | NaCl是氯化钠晶体的分子式 | |
| B. | 氯化钠晶体中一个钠离子吸引一个氯离子 | |
| C. | NaCl晶体中不存在单个分子 | |
| D. | Na+和Cl-的基态最外层电子排布都是3s23p6 |
分析 A.NaCl是离子晶体构成微粒是阴离子和阳离子;
B.根据氯化钠晶胞中每个钠离子周围距离最近的氯离子有6个判断
C.NaCl是离子晶体构成微粒是阴离子和阳离子;
D.Cl-的基态最外层电子排布是3s23p6,Na+的基态最外层电子排布是2s22p6.
解答 解:A.NaCl是离子晶体构成微粒是阴离子和阳离子不存在分子,所以NaCl是氯化钠晶体的化学式不是分子式,故A错误;
B、氯化钠晶胞中每个钠离子周围距离最近的氯离子有6个,所以氯化钠晶体中一个钠离子吸引6个氯离子,故B错误;
C.NaCl是离子晶体构成微粒是阴离子和阳离子不存在分子,故C正确;
D.Cl-的基态最外层电子排布是3s23p6,Na+的基态最外层电子排布是2s22p6,故D错误;
故选C.
点评 本题考查了晶体的结构和性质,注意NaCl是离子晶体构成微粒是阴离子和阳离子不存在分子,难度不大.

练习册系列答案
相关题目
5.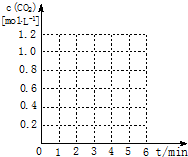 某化学兴趣小组对碳的氧化物做了深入的研究并取得了一些成果.
某化学兴趣小组对碳的氧化物做了深入的研究并取得了一些成果.
已知:C(s)+O2(g)?CO2(g)△H=-393kJ•mol-1;
2CO (g)+O2(g)?2CO2(g)△H=-566kJ•mol-1;
2H2(g)+O2(g)?2H2O(g)△H=-484kJ•mol-1
(1)将水蒸气喷到灼热的炭上实现炭的气化(制得CO、H2),该反应的热化学方程式为C(s)+H2O(g)=CO (g)+H2(g)△H=+132 kJ•mol-1.
(2)将一定量CO(g)和H2O(g)分别通入容积为1L的恒容密闭容器中,发生反应:
CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
①该反应的正反应为放热(填“吸热”或“放热”)反应.
②实验1中,0~4min时段内,以v(H2)表示的反应速率为0.8mol/(L•min).
③实验2达到平衡时CO的转化率为20%.
④实验3与实验2相比,改变的条件是加催化剂;
请在如图坐标中画出“实验2”与“实验3”中c(CO2)随时间变化的曲线,并作必要的标注.
(3)在载人航天器中应用电化学原理,以Pt为阳极,Pb(CO2的载体)为阴极,KHCO3溶液为电解质溶液,
还原消除航天器内CO2同时产生O2和新的能源CO,总反应的化学方程式为:2CO2 $\frac{\underline{\;通电\;}}{\;}$2CO+O2,若阳
极为溶液中的OH-放电,则阳极的电极反应式为4OH--4e-=O2↑+2H2O.
(4)将CO通入银氨溶液中可析出黑色的金属颗粒,其反应方程式为CO+2Ag(NH3)2OH=2Ag↓+(NH4)2CO3+2NH3.
 某化学兴趣小组对碳的氧化物做了深入的研究并取得了一些成果.
某化学兴趣小组对碳的氧化物做了深入的研究并取得了一些成果.已知:C(s)+O2(g)?CO2(g)△H=-393kJ•mol-1;
2CO (g)+O2(g)?2CO2(g)△H=-566kJ•mol-1;
2H2(g)+O2(g)?2H2O(g)△H=-484kJ•mol-1
(1)将水蒸气喷到灼热的炭上实现炭的气化(制得CO、H2),该反应的热化学方程式为C(s)+H2O(g)=CO (g)+H2(g)△H=+132 kJ•mol-1.
(2)将一定量CO(g)和H2O(g)分别通入容积为1L的恒容密闭容器中,发生反应:
CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
| 实验组序 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| H2O | CO | CO2 | |||
| 1 | 500 | 4 | 8 | 3.2 | 4 |
| 2 | 750 | 2 | 4 | 0.8 | 3 |
| 3 | 750 | 2 | 4 | 0.8 | 1 |
②实验1中,0~4min时段内,以v(H2)表示的反应速率为0.8mol/(L•min).
③实验2达到平衡时CO的转化率为20%.
④实验3与实验2相比,改变的条件是加催化剂;
请在如图坐标中画出“实验2”与“实验3”中c(CO2)随时间变化的曲线,并作必要的标注.
(3)在载人航天器中应用电化学原理,以Pt为阳极,Pb(CO2的载体)为阴极,KHCO3溶液为电解质溶液,
还原消除航天器内CO2同时产生O2和新的能源CO,总反应的化学方程式为:2CO2 $\frac{\underline{\;通电\;}}{\;}$2CO+O2,若阳
极为溶液中的OH-放电,则阳极的电极反应式为4OH--4e-=O2↑+2H2O.
(4)将CO通入银氨溶液中可析出黑色的金属颗粒,其反应方程式为CO+2Ag(NH3)2OH=2Ag↓+(NH4)2CO3+2NH3.
10.下列化合物中形成离子键的所有微粒,其基态电子层结构都与氩原子相同的是( )
| A. | Na2O | B. | CaS | C. | KI | D. | NaCl |
3.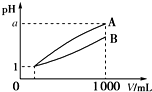 pH=1的两种酸溶液A、B各1mL,分别加水稀释到1 000mL,其pH与溶液体积(V)的关系如图所示,下列说法不正确的是( )
pH=1的两种酸溶液A、B各1mL,分别加水稀释到1 000mL,其pH与溶液体积(V)的关系如图所示,下列说法不正确的是( )
 pH=1的两种酸溶液A、B各1mL,分别加水稀释到1 000mL,其pH与溶液体积(V)的关系如图所示,下列说法不正确的是( )
pH=1的两种酸溶液A、B各1mL,分别加水稀释到1 000mL,其pH与溶液体积(V)的关系如图所示,下列说法不正确的是( )| A. | 若a=4,则A是强酸,B是弱酸 | |
| B. | 稀释后,A酸溶液的酸性比B酸溶液强 | |
| C. | A、B两种酸溶液的物质的量浓度一定不相等 | |
| D. | 若1<a<4,则A、B都是弱酸 |
10.下列化学方程式书写正确的是( )
| A. | 2Na2O2+2H2O═4NaOH | |
| B. | 2S+3O2═2SO3 | |
| C. | 3NO2+2H2O═3HNO3 | |
| D. | MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O |
7.对平衡CO2(g)?CO2(aq);△H<0,为增大二氧化碳气体在水中的溶解度,应采用的方法是( )
| A. | 升温增压 | B. | 降温减压 | C. | 升温减压 | D. | 降温增压 |
8.在pH=1的含Ba2+ 的溶液中,还能大量存在的离子是( )
| A. | Al3+ | B. | ClO- | C. | Cl- | D. | SO42- |
 .
.