题目内容
15.下列说法正确的是:( )①电解质在水中电离时都存在电离平衡;
②升高温度,KW增大,纯水pH不变;
③加水稀释醋酸溶液能促进醋酸电离;
④25℃向水中加入少量稀硫酸,c(H+)增大,KW不变;
⑤氯水和食盐水都能导电,所以Cl2和NaCl都是电解质;
⑥升高温度能促进弱电解质的电离;
⑦强电解质溶液的导电能力比弱电解质溶液的导电能力强.
| A. | ①②⑤⑦ | B. | ②③④⑤⑥ | C. | ③④⑥ | D. | ②③④⑥⑦ |
分析 ①弱酸和弱碱溶液和水,即弱电解质存在电离平衡;
②水的电离为吸热过程,升高温度,KW增大,氢离子浓度变大,纯水pH减小;
③醋酸为弱酸,加水促进电离,可用平衡移动原理解释;
④水的离子积与温度应该,温度不变,水的离子积不变;
⑤电解质是化合物,单质与混合物既不是电解质也不是非电解质;
⑥弱电解质的电离为吸热反应;
⑦溶液的导电能力与离子浓度与离子的电荷有关,浓度越大、所带电荷越大,导电能力越强.
解答 解:①弱电解质存在电离平衡,强电解质不存在电离平衡,比如Ba(OH)2是强碱,能完全电离,不存在电离平衡,故①错误;
②水的电离为吸热过程,升高温度,KW增大,氢离子浓度变大,纯水pH减小,故②错误;
③醋酸为弱酸,加水促进电离,即加水平衡右移,故③正确;
④硫酸是强酸,溶液中完全电离,加入硫酸后溶液中c(H+)增大,由于温度不变,所以水的离子积不变,故④正确;
⑤氯气是单质,不是电解质,食盐水为混合物,既不是电解质也不是非电解质,故⑤错误;
⑥弱电解质的电离是吸热的,故升高温度,促进电离,故⑥正确;
⑦溶液的导电能力与离子浓度与离子的电荷有关,浓度越大、所带电荷越多,导电能力越强,与强弱电解质无关,强电解质溶液的导电能力不一定强,如硫酸钡是强电解质,难溶水,几乎不导电,故⑦错误;综上正确的是③④⑥,故选C.
点评 本题综合考查了弱电解质的电离、水的离子积、溶液的导电能力、电解质的概念等,考查内容较多,题目涉及内容较广,且难度不大,是一道好题.

练习册系列答案
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案
相关题目
11.常温下,已知有某浓度的CH3COOH溶液,下列说法不正确的是( )
| A. | 该溶液与等浓度NaOH溶液等体积混合后,pH>7 | |
| B. | 测得Na2CO3的碱性比CH3COONa溶液强,因此得出醋酸的酸性比碳酸强的结论 | |
| C. | 若向该溶液中加入少量CH3COONa固体,恢复至常温后,c(CH3COOH)比原来增大 | |
| D. | 若向一定浓度的CH3COONa溶液中加入少量CH3COONa固体,恢复至常温后,其水解程度比原来下降 |
6.下列实验能达到实验目的且符合安全要求的是( )
| A. | 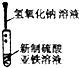 制备氢氧化亚铁 | B. | 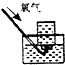 收集氧气 | ||
| C. |  制备并检验氢气的可燃性 | D. | 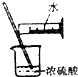 浓硫酸稀释 |
3.分布在三个不同短周期的四种元素A、B、C、D的原子序数依次增大,其中B、C同周期,A、D同主族.常温下,BA3溶液的显碱性;C是地壳中含量最高的元素;D是所在周期原子半径最大的元素.下列说法正确的是( )
| A. | 原子半径:D>C>B>A | |
| B. | 气态氢化物的热稳定性:HmB>HnC | |
| C. | 由A、B、C三种元素形成的化合物均只含有共价键,不含离子键 | |
| D. | 单质D与水反应放出氢气,当转移2NA个电子时,产生氢气的体积为22.4升(标准状况) |
20.下列联系实际的说法正确的是( )
| A. | 可燃冰就是固态甲烷 | |
| B. | 人类目前直接利用的能量大部分是由化学反应产生的 | |
| C. | 煤、石油、天然气都是可再生能源 | |
| D. | 硫和碳的氧化物是形成酸雨的主要物质 |
7.已知短周期元素的离子aA2+、bB+、cC2?、dD?都具有相同的电子层结构,则下列叙述正确的是( )
| A. | 原子半径A>B>C>D | |
| B. | 原子序数d>c>b>a | |
| C. | 离子半径C>D>B>A | |
| D. | 单质的还原性A>B离子的还原性C2?>D? |
4.银锌纽扣电池的总反应式为Zn+Ag2O+H2O=Zn(OH)2+2Ag,下列说法不正确的是( )
| A. | 锌做负极 | B. | 放电时,正极产物是银 | ||
| C. | 电解质溶液不可能呈酸性 | D. | 充电时发生了原电池反应 |
5.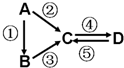 无机物A、B、C、D均为中学化学常见的纯净物,且均含有一种相同元素,它们之间有如图的反应关系(部分生成物和反应条件略去).则下列推断正确的是( )
无机物A、B、C、D均为中学化学常见的纯净物,且均含有一种相同元素,它们之间有如图的反应关系(部分生成物和反应条件略去).则下列推断正确的是( )
 无机物A、B、C、D均为中学化学常见的纯净物,且均含有一种相同元素,它们之间有如图的反应关系(部分生成物和反应条件略去).则下列推断正确的是( )
无机物A、B、C、D均为中学化学常见的纯净物,且均含有一种相同元素,它们之间有如图的反应关系(部分生成物和反应条件略去).则下列推断正确的是( )| A. | 若A是单质,C、D是氧化物,且D能与水反应生成强酸,则A一定是硫 | |
| B. | 若A是一种淡黄色固体,①②反应都有共同的单质生成,则A中阳阴离子个数比为1:1 | |
| C. | 若A物质具有两性,D为白色沉淀,则反应④的转化通入二氧化碳或氨气都能实现 | |
| D. | 若A是应用最广泛的金属,且A与C反应生成D,则②⑤反应的另一反应物一定是Cl2 |
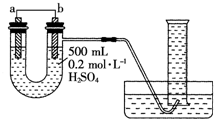 现用如图装置来测定某原电池工作时在某段时间内通过导线的电子的物质的量.量筒的规格为1000mL,供选择的电极材料有纯铜片和纯锌片.请回答下列问题:
现用如图装置来测定某原电池工作时在某段时间内通过导线的电子的物质的量.量筒的规格为1000mL,供选择的电极材料有纯铜片和纯锌片.请回答下列问题: