题目内容
17.下列实验现象与推出的结论都正确的是( )| 选项 | 现象 | 结论 |
| A | Cl2、SO2分别通入紫色石蕊溶液中,溶液均褪色 | 二者均有漂白性 |
| B | CO2、SO2分别通入Ba(NO3)2溶液中,均无沉淀生成 | 弱酸不能制强酸 |
| C | 向溶液中滴加盐酸,产生的气体通入澄清石灰水中,石灰水变浑浊 | 该溶液中一定有CO32- |
| D | 将钾、钠分别放入装有煤油的试管中,二者均下沉到试管底部 | 钾、钠的密度都比煤油大 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.二氧化硫具有漂白性,但不能漂白酸碱指示剂;
B.二氧化硫具有还原性,能被硝酸钡溶液氧化生成硫酸根离子;
C,能和稀盐酸反应生成能使澄清石灰水变浑浊的物质中可能含有碳酸根离子、碳酸氢根离子、亚硫酸根离子或亚硫酸氢根离子;
D.K、Na密度都大于煤油且和煤油不反应.
解答 解:A.二氧化硫具有漂白性,但不能漂白酸碱指示剂,所以二氧化硫只能使紫色石蕊试液变红色,但不能褪色,故A错误;
B.二氧化硫具有还原性,能被硝酸钡溶液氧化生成硫酸根离子,硫酸根离子和钡离子反应生成硫酸钡沉淀,所以有沉淀生成,故B错误;
C,能和稀盐酸反应生成能使澄清石灰水变浑浊的物质中可能含有碳酸根离子、碳酸氢根离子、亚硫酸根离子或亚硫酸氢根离子,所以该溶液中不一定含有碳酸根离子,故C错误;
D.K、Na密度都大于煤油且和煤油不反应,所以将钾、钠分别放入装有煤油的试管中,二者均下沉到试管底部,故D正确;
故选D.
点评 本题考查化学实验方案评价,为高频考点,侧重考查离子检验、物质的性质、氧化还原反应等知识点,明确实验原理及物质性质是解本题关键,易错选项是B,注意二氧化硫具有漂白性但不能漂白酸碱指示剂.

练习册系列答案
相关题目
7.25℃的四种溶液:
①pH=2的CH3COOH溶液②pH=2的HCl溶液③pH=12的氨水④pH=12的NaOH溶液,
有关上述溶液的说法,正确的是( )
①pH=2的CH3COOH溶液②pH=2的HCl溶液③pH=12的氨水④pH=12的NaOH溶液,
有关上述溶液的说法,正确的是( )
| A. | ①、④溶液中水电离的c( H+):①>④ | |
| B. | 将②、③溶液混合后pH=7,则消耗溶液的体积:②<③ | |
| C. | 将①、④溶液混合后pH=8,则c(Na+)-c(CH3COO-)=9.9×10-7mol•L-1 | |
| D. | 分别向等体积的上述溶液中加入100 mL,水,溶液的pH:③>④>①>② |
8.新鲜水果、蔬菜、乳制品中富含的维生素C具有明显的抗衰老作用,但易被空气氧化.某课外小组利用碘滴定法测某橙汁中维生素C的含量,其化学方程式如下:下列说法正确的是( )
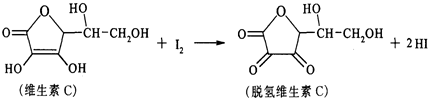

| A. | 上述反应为 取代反应 | |
| B. | 维生素C在酸性条件下水解只得到1种产物 | |
| C. | 滴定时可用淀粉溶液作指示剂 | |
| D. | 维生素C的分子式为C6H10O6 |
5.碱金属与卤素所形成的化合物大都具有的性质是( )
①熔沸点较高 ②能溶于水 ③水溶液能导电 ④有较深的颜色 ⑤熔融状态不导电.
①熔沸点较高 ②能溶于水 ③水溶液能导电 ④有较深的颜色 ⑤熔融状态不导电.
| A. | ①②③ | B. | ③④⑤ | C. | ①④⑤ | D. | ②③⑤ |
12.某容积固定的密闭容器中放入一定量的NO2,发生反应2NO2(g)?N2O4(g)△H<0,在达平衡后,若分别单独改变下列条件,重新达到新平衡后,能使平衡混合气体平均相对分子质量减小的是( )
| A. | 通入Ne | B. | 通入NO2 | C. | 通入N2O4 | D. | 以上都不行 |
2.超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层.科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,其反应为:2NO+2CO$\frac{\underline{\;催化剂\;}}{\;}$2CO2+N2.
为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)前2s内的平均反应速率v(N2)=1.88×10-4mol•L-1•S-1.
(2)在该温度下,反应的平衡常数K=5000 L•mol-1.
(3)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率.为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中.
①请在上表空格中填入剩余的实验条件数据.
②请在给出的坐标图中,画出上表中的三个实验条件下混合气体中NO浓度随时间变化的趋势曲线图,并标明各条曲线的实验编号.
为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)(mol/L) | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)(mol/L) | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
(1)前2s内的平均反应速率v(N2)=1.88×10-4mol•L-1•S-1.
(2)在该温度下,反应的平衡常数K=5000 L•mol-1.
(3)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率.为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中.
| 实验 编号 | T(℃) | NO初始浓度 (mol/L) | CO初始浓度 (mol/L) | 催化剂的比表面积(m2/g) |
| Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| Ⅱ | 124 | |||
| Ⅲ | 350 | 124 |
②请在给出的坐标图中,画出上表中的三个实验条件下混合气体中NO浓度随时间变化的趋势曲线图,并标明各条曲线的实验编号.

9.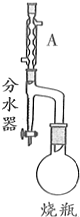 实验室制备甲基丙烯酸甲酯的反应装置示意图和有关信息如下:
实验室制备甲基丙烯酸甲酯的反应装置示意图和有关信息如下:

实验步骤:
向100mL烧瓶中依次加入:15mL甲基丙烯酸、2粒沸石、10mL无水甲醇、适量的浓硫酸;按图示连接装置加热烧瓶中混合液,通过分水器分离出水,用锥形瓶盛接收集产生的水;当不再有水生成,停止加热;冷却后用试剂X洗涤烧瓶中的混合溶液并分离;取有机层混合液减压蒸馏,得到较纯净的甲基丙烯酸甲酯.请回答下列问题:
(1)A装置的名称是球形冷凝管.
(2)上述实验中浓硫酸有提高甲基丙烯酸甲酯产率的作用,其原理浓硫酸吸收产物水,能使酯化反应向正方向移动.但是浓硫酸过多,产率降低,原因是浓硫酸具有强氧化性,能氧化有机反应物.
(3)上述实验可能生成的副产物结构简式为CH3OCH3(填一种即可)
(4)试剂X宜选择c.
a.饱和食盐水 b.氢氧化钠溶液 c.饱和碳酸钠溶液
(5)实验结束收集分水器分离出的水,并测得质量为2.70g,计算甲基丙烯酸甲酯的产率约为85.2%.实验中甲基丙烯酸甲酯的实际产率总是小于此计算值,其原因不可能是c.
a.分水器收集的水里含甲酯
b.实验条件下发生副反应
c.产品精制时收集部分低沸点物质
d.产品在洗涤、蒸发过程中有损失.
 实验室制备甲基丙烯酸甲酯的反应装置示意图和有关信息如下:
实验室制备甲基丙烯酸甲酯的反应装置示意图和有关信息如下:
| 药品 | 相对分子质量 | 熔点/℃ | 沸点/℃ | 溶解性 | 密度(g•cm-3) |
| 甲醇 | 32 | -98 | -64.5 | 与水混溶,易溶于有机溶剂 | 0.79 |
| 甲基丙烯酸 | 86 | 15 | 161 | 溶于热水,易溶于有机剂 | 1.01 |
| 甲基丙烯酸甲酯 | 100 | -48 | 100 | 微溶于水,易溶于有机溶剂 | 0.944 |
向100mL烧瓶中依次加入:15mL甲基丙烯酸、2粒沸石、10mL无水甲醇、适量的浓硫酸;按图示连接装置加热烧瓶中混合液,通过分水器分离出水,用锥形瓶盛接收集产生的水;当不再有水生成,停止加热;冷却后用试剂X洗涤烧瓶中的混合溶液并分离;取有机层混合液减压蒸馏,得到较纯净的甲基丙烯酸甲酯.请回答下列问题:
(1)A装置的名称是球形冷凝管.
(2)上述实验中浓硫酸有提高甲基丙烯酸甲酯产率的作用,其原理浓硫酸吸收产物水,能使酯化反应向正方向移动.但是浓硫酸过多,产率降低,原因是浓硫酸具有强氧化性,能氧化有机反应物.
(3)上述实验可能生成的副产物结构简式为CH3OCH3(填一种即可)
(4)试剂X宜选择c.
a.饱和食盐水 b.氢氧化钠溶液 c.饱和碳酸钠溶液
(5)实验结束收集分水器分离出的水,并测得质量为2.70g,计算甲基丙烯酸甲酯的产率约为85.2%.实验中甲基丙烯酸甲酯的实际产率总是小于此计算值,其原因不可能是c.
a.分水器收集的水里含甲酯
b.实验条件下发生副反应
c.产品精制时收集部分低沸点物质
d.产品在洗涤、蒸发过程中有损失.