题目内容
5.碱金属与卤素所形成的化合物大都具有的性质是( )①熔沸点较高 ②能溶于水 ③水溶液能导电 ④有较深的颜色 ⑤熔融状态不导电.
| A. | ①②③ | B. | ③④⑤ | C. | ①④⑤ | D. | ②③⑤ |
分析 碱金属元素易失电子,卤族元素易得电子,碱金属族卤化物都易溶于水、熔沸点较高,其水溶液能导电,据此分析解答.
解答 解:碱金属元素易失电子,卤族元素易得电子,碱金属族卤化物都是离子化合物,离子键导致其熔沸点较高,且易溶于水,在水溶液中易电离生成自由移动的阴阳离子而导致其溶液导电,不一定有颜色,如NaCl无色,熔融状态下能电离出自由移动的阴阳离子而导电,故选A.
点评 本题以碱金属、卤族元素为载体考查离子化合物结构、性质,为高频考点,侧重考查学生分析判断能力,知道离子化合物和共价化合物区别,题目难度不大.

练习册系列答案
相关题目
16.化学反应的能量变化、速率、限度是化学研究的重要内容.
(1)有关研究需要得到C3H8(g)=3C(石墨,s)+4H2(g)的△H,但测定实验难进行.
设计如图1可计算得到:
①△H>0(填>、<或=)
②△H=△H1-△H2-△H3.(用图中其它反应的反应热表示)
(2)甲酸、甲醇、甲酸甲酯是重要化工原料.它们的一些性质如下:
工业制备甲酸原理:HCOOCH3(l)+H2O(l)$\stackrel{H+}{?}$ HCOOH(l)+CH3OH(l),反应吸热,但焓变的值很小.常温常压下,水解反应速率和平衡常数都较小.
①工业生产中,反应起始,在甲酸甲酯和水的混合物中加入少量甲酸和甲醇,从反应速率和限度的角度分析所加甲酸和甲醇对甲酸甲酯水解的影响.甲醇:是很好的溶剂,能溶于水和HCOOCH3,增大反应接触面积,加快反应速率;同时,甲醇也是生成物,生物浓度增加,不利于平衡右移.甲酸:甲酸能电离出H+作催化剂能加快反应速率,同时,甲酸也是生成物,生成物浓度增加,不利于平衡右移.某小组通过试验研究反应HCOOCH3转化率随时间变化的趋势,在温度T1下,采用酯水比为1:2进行实验,测得平衡是HCOOCH3的转化率为25%.
②预测HCOOCH3转化率随时间的变化趋势并画图2表示.
③该反应在温度T1下的平衡常数K=0.048.(保留两位有效数字)
(3)HCOOH成为质子膜燃料电池的燃料有很好的发展前景.写出该燃料电池的电极反应式:O2 +4e-+4H+=2H2O; 2HCOOH-4e-=2CO2 ↑+4H+.
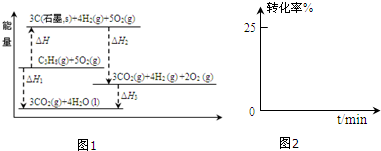
(1)有关研究需要得到C3H8(g)=3C(石墨,s)+4H2(g)的△H,但测定实验难进行.
设计如图1可计算得到:
①△H>0(填>、<或=)
②△H=△H1-△H2-△H3.(用图中其它反应的反应热表示)
(2)甲酸、甲醇、甲酸甲酯是重要化工原料.它们的一些性质如下:
| 物质 | HCOOH | CH3OH | HCOOCH3 |
| 主要 性质 | 无色液体,与水互溶 K(HCOOH)>K(CH3COOH) | 无色液体,与水互溶 | 无色液体,在水中溶解度小,与醇互溶 |
①工业生产中,反应起始,在甲酸甲酯和水的混合物中加入少量甲酸和甲醇,从反应速率和限度的角度分析所加甲酸和甲醇对甲酸甲酯水解的影响.甲醇:是很好的溶剂,能溶于水和HCOOCH3,增大反应接触面积,加快反应速率;同时,甲醇也是生成物,生物浓度增加,不利于平衡右移.甲酸:甲酸能电离出H+作催化剂能加快反应速率,同时,甲酸也是生成物,生成物浓度增加,不利于平衡右移.某小组通过试验研究反应HCOOCH3转化率随时间变化的趋势,在温度T1下,采用酯水比为1:2进行实验,测得平衡是HCOOCH3的转化率为25%.
②预测HCOOCH3转化率随时间的变化趋势并画图2表示.
③该反应在温度T1下的平衡常数K=0.048.(保留两位有效数字)
(3)HCOOH成为质子膜燃料电池的燃料有很好的发展前景.写出该燃料电池的电极反应式:O2 +4e-+4H+=2H2O; 2HCOOH-4e-=2CO2 ↑+4H+.
20.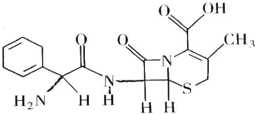 头孢拉定片(Cefradine Tablets),又称先锋,其结构式如图所示,有关该物质的描述正确的是( )
头孢拉定片(Cefradine Tablets),又称先锋,其结构式如图所示,有关该物质的描述正确的是( )
 头孢拉定片(Cefradine Tablets),又称先锋,其结构式如图所示,有关该物质的描述正确的是( )
头孢拉定片(Cefradine Tablets),又称先锋,其结构式如图所示,有关该物质的描述正确的是( )| A. | 分子式为C16H20N3O4S | |
| B. | 该物质在一定条件下能发生水解 | |
| C. | 该有机物质属于芳香族化合物 | |
| D. | 该物质不能与NaHCO3溶液反应放出CO2 |
10.NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 标准状况下,0.1molCl2溶于水,转移的电子数目为0.1NA | |
| B. | 常温常压下,7.8gNa2S和Na2O2固体中含有的阴离子总数为0.1NA | |
| C. | 5.6gFe与标准状况下2.24L氯气充分反应失去电子数为0.3NA | |
| D. | 标准状态下,33.6L氟化氢中含有氟原子的数目为1.5NA |
17.下列实验现象与推出的结论都正确的是( )
| 选项 | 现象 | 结论 |
| A | Cl2、SO2分别通入紫色石蕊溶液中,溶液均褪色 | 二者均有漂白性 |
| B | CO2、SO2分别通入Ba(NO3)2溶液中,均无沉淀生成 | 弱酸不能制强酸 |
| C | 向溶液中滴加盐酸,产生的气体通入澄清石灰水中,石灰水变浑浊 | 该溶液中一定有CO32- |
| D | 将钾、钠分别放入装有煤油的试管中,二者均下沉到试管底部 | 钾、钠的密度都比煤油大 |
| A. | A | B. | B | C. | C | D. | D |
14.a、b、c、d、e分别为MgC12、KHSO4、KOH、NaHCO3、A1C13溶液中的一种,已知:
①a能与其它4种溶液反应,且a与c、e反应时有明显现象;
②b与d反应只产生气泡;
③e只能与a反应;
下列推理不正确的是( )
①a能与其它4种溶液反应,且a与c、e反应时有明显现象;
②b与d反应只产生气泡;
③e只能与a反应;
下列推理不正确的是( )
| A. | a一定是KOH | B. | c一定是A1C13 | C. | e一定是MgC12 | D. | b一定是KHSO4 |
 运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义
运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义 .B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
.B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题: ,这样排布遵循了泡利原理和洪特规则.
,这样排布遵循了泡利原理和洪特规则.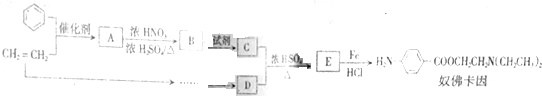

 ,生成A的反应类型为加成反应.
,生成A的反应类型为加成反应.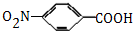 $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$ +H2O.
+H2O. 等.
等.