题目内容
【题目】某实验小组用下列装置进行乙醇催化氧化的实验。
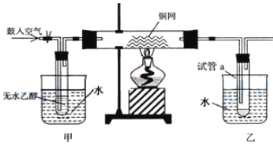
(1)请写出乙醇催化氧化的化学方程式:_____。
(2)反应进行一段时间后,试管a中收集到的主要有机生成物是_____(写名称)。若要检验试管a中收集的该物质,应用_____(试剂名称)来检验,发生的反应方程式为_____。
(3)若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有_____。要除去该物质,可在混合液中加入_____(填写序号)。
a.氯化钠溶液 b.苯 c.碳酸氢钠溶液 d.四氯化碳
【答案】2CH3CH2OH+O2![]() 2CH3CHO+2H2O 乙醛 新制Cu(OH)2或银氨溶液 CH3CHO+NaOH+2Cu(OH)2
2CH3CHO+2H2O 乙醛 新制Cu(OH)2或银氨溶液 CH3CHO+NaOH+2Cu(OH)2![]() CH3COONa+Cu2O↓+3H2O或CH3CHO+2Ag(NH3)2OH
CH3COONa+Cu2O↓+3H2O或CH3CHO+2Ag(NH3)2OH![]() CH3COONH4+H2O+2Ag↓+3NH3 乙酸 c
CH3COONH4+H2O+2Ag↓+3NH3 乙酸 c
【解析】
装置甲中进行热水浴,产生乙醇蒸气进入装有铜丝的硬质玻璃管中,而装置乙中进行冷水浴,用于冷却收集得到的氧化产物,鼓入空气是为了保证反应器中有充分的氧气来氧化乙醇,据此来分析题目即可。
(1)乙醇催化氧化可以得到乙醛,方程式为2CH3CH2OH+O2![]() 2CH3CHO+2H2O;
2CH3CHO+2H2O;
(2)a中收集到的有机物主要就是乙醇的催化氧化产物,即乙醛,若要检验乙醛,实验室中常用新制![]() 悬浊液或银氨溶液来检验其醛基,发生的反应为CH3CHO+NaOH+2Cu(OH)2
悬浊液或银氨溶液来检验其醛基,发生的反应为CH3CHO+NaOH+2Cu(OH)2![]() CH3COONa+Cu2O↓+3H2O或CH3CHO+2Ag(NH3)2OH
CH3COONa+Cu2O↓+3H2O或CH3CHO+2Ag(NH3)2OH![]() CH3COONH4+H2O+2Ag↓+3NH3;
CH3COONH4+H2O+2Ag↓+3NH3;
(3)石蕊显红色证明有酸性物质产生,可能为乙醛进一步被氧化得到了乙酸,若要除去乙醛中的乙酸,可以考虑选用一种碱性物质,即碳酸氢钠溶液,答案选c。

 阅读快车系列答案
阅读快车系列答案【题目】氯胺是一种长效缓释水消毒剂,主要包括一氯胺、二氯胺和三氯胺(NH2Cl,NHCl2和NCl3)。工业上可利用NH3(g)+Cl2(g) ![]() NH2Cl(g)+HCl(g)制备一氯胺。回答下列问题:
NH2Cl(g)+HCl(g)制备一氯胺。回答下列问题:
(1)氯胺作饮用水消毒剂是因为水解生成具有强烈杀菌作用的物质,该物质是___,二氯胺与水反应的化学方程式为___。
(2)已知部分化学键的键能和化学反应的能量变化如表和如图所示(忽略不同物质中同种化学键键能的细微差别)。
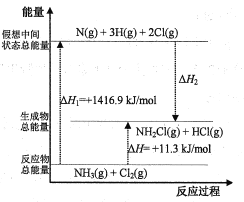
化学键 | N-H | N-Cl | H-Cl |
键能(kJ/mol) | 391.3 | x | 431.8 |
则ΔH2=___kJ/mol,x=___。
(3)在密闭容器中反应NH3(g)+Cl2(g) ![]() NH2Cl(g)+HCl(g)达到平衡,据此反应通过热力学定律计算理论上NH2Cl的体积分数随
NH2Cl(g)+HCl(g)达到平衡,据此反应通过热力学定律计算理论上NH2Cl的体积分数随![]() (氨氯比)的变化曲线如图所示。
(氨氯比)的变化曲线如图所示。
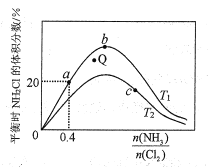
①a、b、c三点对应平衡常数的大小关系是___。T1温度下该反应的平衡常数为___(列出算式即可)。
②在T2温度下,Q点对应的速率:v正___v逆(填“大于”“小于”或“等于”)。
③在氨氯比一定时,提高NH3的转化率的方法是___(任写1种)
④若产物都是气体,实验测得NH2Cl的体积分数始终比理论值低,原因可能是___。
【题目】将5mL 0.005mol/L FeCl3溶液和5mL 0.015mol/L KSCN溶液混合,达到平衡后呈红色。再将混合液分为5份,分别进行如下实验:下列说法不正确的是( )
| 实验①:滴加4滴水,振荡 |
实验②:滴加4滴饱和FeCl3溶液,振荡 | |
实验③:滴加4滴1 mol/L KCl溶液,振荡 | |
实验④:滴加4滴1 mol/L KSCN溶液,振荡 | |
实验⑤:滴加4滴6 mol/L NaOH溶液,振荡 |
A.对比实验①和②,为了证明增加反应物浓度,平衡发生正向移动
B.对比实验①和③,为了证明增加反应物浓度,平衡发生逆向移动
C.对比实验①和④,为了证明增加反应物浓度,平衡发生正向移动
D.对比实验①和⑤,为了证明减少反应物浓度,平衡发生逆向移动