题目内容
【题目】已知氧化性:BrO3->IO3->Br2>I2。向含6molKI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加KBrO3的物质的量的关系如图所示。请回答下列问题:
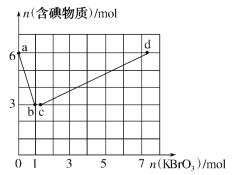
(1)b点时,KI反应完全,则消耗的氧化剂与还原剂物质的量之比为__,还原产物是__。
(2)已知b→c过程中,仅有一种元素发生化合价变化,写出并配平该反应的离子方程式___。
(3)①已知反应:2BrO3-+I2→2IO3-+Br2;有同学由此得出氧化性:I2>Br2的结论,你认为是否正确___,并说明理由:___。
(4)计算c→d过程中消耗KBrO3的物质的量___。(写出计算过程)
【答案】1:6 KBr BrO3-+5Br-+6H+=3Br2+3H2O 不正确 该反应中I2做还原剂,Br2为还原产物,所以得出还原性I2>Br2 6mol
【解析】
根据氧化还原反应中元素化合价的变化及电子转移守恒分析解答。
(1)b点时,KI反应完全,由图象可知参加反应的KI为6mol,KBrO3为1mol,则消耗的氧化剂与还原剂物质的量之比为1:6,发生反应为6H++6I-+BrO3-=Br-+3I2+3H2O,还原产物是KBr,故答案为:1:6;KBr;
(2)b→c过程中,仅有一种元素发生化合价变化,应是BrO3-与Br-之间的氧化还原反应,反应的离子方程式为BrO3-+5Br-+6H+=3Br2+3H2O,故答案为:BrO3-+5Br-+6H+=3Br2+3H2O;
(3)反应2BrO3-+I2=2IO3-+Br2中,I2为还原剂,Br2为还原产物,应有还原性I2>Br2,该同学的结论不正确,故答案为:不正确,该反应中I2作还原剂,Br2为还原产物,应得出还原性I2>Br2结论;
(4)发生的反应依次有6H++6I-+BrO3-=Br-+3I2+3H2O,BrO3-+5Br-+6H+=3Br2+3H2O,2BrO3-+I2=2IO3-+Br2,图中c→d段参加反应的碘为3mol,c→d过程中发生2BrO3-+I2=2IO3-+Br2,则消耗n(KBrO3)为3mol×2=6mol,故答案为:6mol。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】氨气是一种重要的化工原料,在工农业生产中有广泛的应用。
(1)在一定温度下,在固定体积的密闭容器中进行可逆反应:CO+2H2![]() CH3OH(g)。该可逆反应达到平衡的标志是________。
CH3OH(g)。该可逆反应达到平衡的标志是________。
A.2 v正(H2)= v逆(CH3OH)
B.单位时间生成m molCO的同时生成2m molH2
C.容器内气体的平均相对分子质量不再随时间而变化
D.混合气体的密度不再随时间变化
(2)工业上可用天然气为原料来制取化工原料气氢气,某研究性学习小组的同学模拟工业制取氢气的原理,在一定温度下,体积为2L的恒容密闭容器中,测得如下表所示数据。
时间/min | CH4(mol) | H2O(mol) | CO(mol) | H2(mol) |
0 | 0.40 | 1.00 | 0 | 0 |
5 | a | 0.80 | c | 0.60 |
7 | 0.20 | b | 0.20 | d |
10 | 0.21 | 0.81 | 0.19 | 0.64 |
请回答下列问题:
①该温度下,上述反应的平衡常数K=________;
②反应在7~10min内,CO的物质的量减少的原因可能是____________(填字母)。
A.减少CH4的物质的量 B.降低温度
C.升高温度 D.充入H2
③若保持相同的温度,向2L的恒容器密闭容器中同时充入0.2molCH4、0.62molH2O、a molCO和0.5molH2,当a =0.2时,上述反应向_____(填“正反应”或“逆反应”)方向进行。若要使上述反应开始时向逆反应方向进行,则a的取值范围为__________。
【题目】某化学兴趣小组利用硫酸铁溶液与铜粉反应,又向反应后溶液中加入KSCN溶液以检验Fe3+是否有剩余,实验记录如下;
实验编号 | 操作 | 现象 |
实验1 |
| i.加入Cu粉后充分振荡,溶液逐渐变蓝; ii.取少量i中清液于试管中,滴加2滴 0.2mol/LKSCN溶液,溶液变为红色,但振荡后红色迅速褪去并有白色沉淀生成。 |
(1)写出实验1中第i步的离子方程式_______________。甲同学猜想第ii步出现的异常现象是由于溶液中的Cu2+干扰了检验Fe3+的现象。查阅相关资料如下
①2Cu2++4SCN- ![]() 2CuSCN↓(白色)+(SCN)2(黄色)
2CuSCN↓(白色)+(SCN)2(黄色)
②硫氰[(SCN)2]:是一种拟卤素,性质与卤素单质相似,其氧化性介于Br2和I2之间。
该同学又通过如下实验验证猜想
实验编号 | 操作 | 现象 |
实验2 |
| 溶液呈绿色,一段时间后后开始出现白色沉淀,上层溶液变为黄色 |
实验3 |
| 无色溶液立即变红,同时生成白色沉淀。 |
(2)经检测,实验2反应后的溶液pH值减小,可能的原因是___________________________________________。
(3)根据实验2、3的实验现象,甲同学推断实验3中溶液变红是由于Fe2+被(SCN)2氧化,写出溶液变红的离子方程式_______________________。继续将实验2中的浊液进一步处理,验证了这一结论的可能性。

补充实验4的目的是排除了溶液存在Cu2+的可能,对应的现象是____________________________________________。
(4)乙同学同时认为,根据氧化还原反应原理,在此条件下,Cu2+也能氧化Fe2+,他的判断依据是_______。
(5)为排除干扰,小组同学重新设计如下装置。
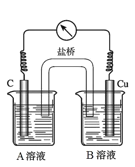
①A溶液为____________________________。
②“电流表指针偏转,说明Cu与Fe3+发生了反应”,你认为这种说法是否合理?__________________(填合理或不合理),原因是__________________________________________。
③验证Fe3+是否参与反应的操作是________________________________________