题目内容
6.某课外学习小组在学习了Na2O2与CO2的反应后,认为Na2O2与SO2应该也可以反应.他们设计了下图装置(夹持装置已略去,装置的气密性良好)进行实验,探究SO2与Na2O2反应的产物,请按要求回答下列问题.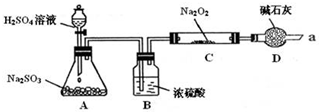
写出装置A中发生反应的化学方程式:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O.
装置D的作用:除了可以防止空气中的CO2、水蒸气等进入C中与Na2O2反应,还可以吸收尾气在通入足量的SO2与Na2O2充分反应后,他们对C中固体产物提出如下假设:
假设1:只有Na2SO3;假设2:只有Na2SO4;假设3:既有Na2SO3,又有Na2SO4.
(1)若假设1成立,写出SO2与Na2O2反应的化学方程式:2Na2O2+2SO2=2Na2SO3+O2↑.
(2)为进一步确定C中反应后固体产物的成分(Na2O2已反应完全),甲同学设计了如下实验:

甲同学由此得出结论:产物是Na2SO4,该方案是否合理否否(填“是”或“否”),理由是硝酸有强氧化性,硝酸可以将BaSO3沉淀氧化为BaSO4
(3)乙同学设计了如下实验验证假设3成立,请帮助他完成下表.
| 实验步骤 | 现象 |
| ①取少量C中固体产物于试管中,加入适量的蒸馏水溶解. | 固体全部溶解 |
| ②向上试管中加入过量的稀盐酸,将产生的气体通入少量酸性KMnO4溶液中. | KMnO4溶液紫色褪去 |
| ③向步骤②反应后的试管中,加入适量的BaCl2溶液. | 产生白色沉淀 |
分析 装置A中亚硫酸钠与硫酸反应生成硫酸钠、二氧化硫气体和水;装置D还能够吸收多余的二氧化硫,防止污染空气;类比过氧化钠与二氧化碳气体的反应,过氧化钠与二氧化硫反应可能生成亚硫酸钠和氧气,过氧化钠具有强氧化性,反应产物可能为硫酸钠,据此完成假设;
(1)假设1:只有Na2SO3,说明过氧化钠与二氧化硫反应生成亚硫酸钠和氧气,据此写出反应的化学方程式;
(2)硝酸有强氧化性,能把亚硫酸根离子氧化成硫酸根离子;
(3)要做验证固体有Na2SO3和Na2SO4,可以检验SO32-与SO42-,先用稀盐酸将亚硫酸根离子转化成二氧化硫,用高锰酸钾溶液检验二氧化硫;然后用氯化钡溶液具有硫酸根离子即可.
解答 解:装置A中亚硫酸钠与硫酸反应的离子方程式为:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O;装置D起到的作用是防止空气中的水蒸气和二氧化碳进入C装置与Na2O2反应,还起到了吸收过量的SO2,避免污染空气;二氧化硫与过氧化钠反应的方程式可能为:2Na2O2+2SO2=2Na2SO3+O2↑,有可能为:Na2O2+SO2=Na2SO4,所以假设假设1:只有Na2SO3;假设3:既有Na2SO3,又有Na2SO4;产物还可能只有硫酸钠,所以假设2为:只有Na2SO4,
故答案为:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O;吸收尾气(未反应完全的SO2气体),防止污染空气;只有Na2SO4 ;
(1)根据假设1可知,反应产物只有亚硫酸钠,说明过氧化钠与二氧化硫反应生成亚硫酸钠和氧气,反应的化学方程式为:2Na2O2+2SO2=2Na2SO3+O2↑,
故答案为:2Na2O2+2SO2=2Na2SO3+O2↑;
(2)生成的白色沉淀中如果含有亚硫酸钡,加入硝酸后,会将亚硫酸钡氧化为硫酸钡,不能确定产物是Na2SO3还是Na2SO4或二者兼有,故不能得出产物只有Na2SO4的结论,
故答案为:否;硝酸有强氧化性,硝酸可以将BaSO3沉淀氧化为BaSO4;
(3)要做验证固体有Na2SO3和Na2SO4,可以检验SO32-与SO42-,实验方案为:①取少量C中固体产物于试管中,加入适量的蒸馏水溶解,固体完全溶解;②向上试管中加入过量的稀盐酸,将亚硫酸钠完全转化成二氧化碳气体,将产生的气体通入少量酸性KMnO4溶液中,高锰酸钾溶液褪色,证明产物中含有亚硫酸钠;③向步骤②反应后的试管中,加入适量的BaCl2溶液,产生白色沉淀,该白色沉淀为硫酸钡,说明原溶液中含有硫酸钠,从而证明假设3成立;
二氧化硫具有还原性,能够被酸性高锰酸钾溶液氧化,反应的离子方程式为:2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+,
故答案为:稀盐酸; 紫色褪去(褪色); 2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+.
点评 本题考查性质实验方案设计,题目难度较大,理解反应原理是解答关键,需要学生具有扎实的基础知识与综合运用知识分析解决问题的能力,注意掌握常见物质的性质及检验方法,明确性质实验方案设计与评价的原则.

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案| A. | 甲烷与氯气在光照条件下的反应和乙酸与乙醇生成乙酸乙酯的反应均属于取代反应 | |
| B. | 顺-2-丁烯和反-2-丁烯的熔、沸点不相同 | |
| C. | C4H9Br的同分异构体有3种 | |
| D. | 乙烯、苯分子中的所有原子都在同一平面上 |
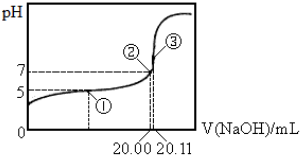
| A. | 该温度下CH3COOH的电离平衡常数约为1.8×10-5 | |
| B. | 点①处溶液中c(CH3COO-)<c(CH3COOH) | |
| C. | 点③处溶液中c(OH-)=c(CH3COOH)+c(H+) | |
| D. | 滴定过程中不可能出现:c(CH3COOH)>c(CH3COO-)>c(OH-)>c(Na+)>c(H+) |
| A. | 配离子只能存在于晶体中 | |
| B. | 配位体只能是多原子分子 | |
| C. | 配合物的稳定性是指配合物在受热情况下是否易分解 | |
| D. | 血红素中的Fe2+与CO形成的配合物比与O2形成的配合物稳定 |
 (1)拆开1mol H-H键、1mol N-H键、1mol N=N键分别需要吸收的能量为436KJ,391KJ,946KJ,求:则①1molN2生成NH3需要放出(吸收或放出)热量92KJ;
(1)拆开1mol H-H键、1mol N-H键、1mol N=N键分别需要吸收的能量为436KJ,391KJ,946KJ,求:则①1molN2生成NH3需要放出(吸收或放出)热量92KJ;