题目内容
6.实验室用铅蓄电池作电源电解饱和食盐水制取氯气,已知铅蓄电池放电时发生如下反应:负极:Pb+SO42-=PbSO4+2e-
正极:PbO2+4H++SO42-+2e-=PbSO4+2H2O
今若制得Cl2 0.10mol,这时电池内消耗的H2SO4的物质的量至少是( )
| A. | 0.025 mol | B. | 0.050 mol | C. | 0.10 mol | D. | 0.20 mol |
分析 由正极、负极电极反应式可知,电池总反应为:PbO2+Pb+2H2SO4=2PbSO4+2H2O,根据电子转移守恒计算参加反应Pb的物质的量,再根据电池总反应进行消耗硫酸物质的量.
解答 解:根据电子转移守恒,结合负极:Pb+SO42-=PbSO4+2e-,可知生成0.1mol氯气时,参加反应Pb的物质的量$\frac{0.1mol×2}{2}$=0.1mol,由正极、负极电极反应式可知,电池总反应为:PbO2+Pb+2H2SO4=2PbSO4+2H2O,故消耗硫酸至少为0.1mol×2=0.2mol,
故选D.
点评 本题考查原电池及电解池的有关计算,注意原电池中正极、负极均消耗硫酸,转移利用电子转移守恒进行计算,难度不大.

练习册系列答案
相关题目
14.下列有关实验装置进行的相应实验,能达到实验目的是( )
| A. | 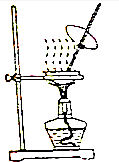 可用来蒸发FeCl3 溶液获得纯FeCl3 固体 | |
| B. |  可用向上排空气法收集CO2、NO 等气体 | |
| C. | 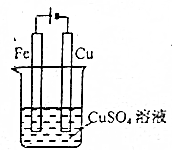 可以实现在铁棒上镀上一层铜 | |
| D. | 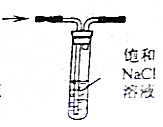 可以除去Cl2中混有的HCl |
15.一定量铜在某浓硝酸溶液中完全溶解,已知参加反应的30g HNO3中被还原的HNO3质量为13g,则生成的NO和NO2的体积比为(同温同压下测定)( )
| A. | 1:1 | B. | 1:2 | C. | 2:11 | D. | 4:1 |
14.已知:
(1)C(s)+O2(g)═CO2(g)△H1=-393.5kJ•mol-1
(2)H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H2=-285.8kJ•mol-1
(3)CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H3=-870.3kJ•mol-1
根据以上方程式可以计算出2C(s)+2H2(g)+O2(g)═CH3COOH(l)的反应热为( )
(1)C(s)+O2(g)═CO2(g)△H1=-393.5kJ•mol-1
(2)H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H2=-285.8kJ•mol-1
(3)CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H3=-870.3kJ•mol-1
根据以上方程式可以计算出2C(s)+2H2(g)+O2(g)═CH3COOH(l)的反应热为( )
| A. | +244.1 kJ•mol-1 | B. | -488.3 kJ•mol-1 | C. | -996.6 kJ•mol-1 | D. | +996.6 kJ•mol-1 |
1.在理论上不能用于设计原电池的化学反应是 ( )
| A. | NaCl(aq)+AgNO3(aq)=AgCl(s)+NaNO3(aq )△H<0 | |
| B. | 2KMnO4(s)=2K2MnO4(s)+MnO2(s)+O2(g)△H>0 | |
| C. | 2FeCl3(aq)+Fe(s)=3FeCl3(aq)△H<0 | |
| D. | 2H2(g)+O2(g)=2H2O (l)△H<0 |
11.下列说法正确的是( )
①22.4L氧气中一定含有NA个氧分子
②将80gNaOH溶于1L水中,所得溶液中NaOH的物质的量浓度是2mol/L
③18g水在标准状况下的体积为22.4L
④在常温常压下,20mLNH3和60mL氧气所含 分子数之比为1:3.
①22.4L氧气中一定含有NA个氧分子
②将80gNaOH溶于1L水中,所得溶液中NaOH的物质的量浓度是2mol/L
③18g水在标准状况下的体积为22.4L
④在常温常压下,20mLNH3和60mL氧气所含 分子数之比为1:3.
| A. | ①②③④ | B. | ①②④ | C. | ②③ | D. | ④ |
15.下列热化学方程式中△H代表燃烧热的是( )
| A. | C6H12O6(s)+6O2(g)=6CO2(g)+6H2O(l)△H1 | B. | S(s)+3/2O2(g)=SO3(s)△H2 | ||
| C. | CH4(g)+2O2(g)=2H2O(l)+CO(g)△H3 | D. | 2CO(g)+O2(g)=CO2(g)△H4 |
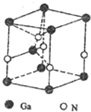 碳、氮元素及其化合物在生产、生活和科学研究等方面有着重要的作用研究它们的结构与性质意义重大.请回答下列有关问题:
碳、氮元素及其化合物在生产、生活和科学研究等方面有着重要的作用研究它们的结构与性质意义重大.请回答下列有关问题: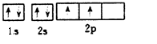 .
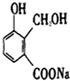
. 有一化合物(X)结构简式如图,它与分别与金属钠、氢氧化钠和碳酸氢钠反应时,不可能生成的产物是( )
有一化合物(X)结构简式如图,它与分别与金属钠、氢氧化钠和碳酸氢钠反应时,不可能生成的产物是( )