题目内容
13.能用OH-+H+═H2O 这个离子方程式表示的化学反应的是( )| A. | 氢氧化铝和硝酸溶液反应 | B. | Fe(OH)3溶液和硫酸反应 | ||
| C. | 氢氧化钡溶液和稀硫酸 | D. | KOH溶液和稀硝酸反应 |
分析 OH-+H+═H2O 表示可溶性强碱与可溶性强酸反应生成水和可溶性盐,据此解答.
解答 解:A.氢氧化铝为难溶性碱,书写离子方程式不能拆,所以氢氧化铝和硝酸溶液反应不能用OH-+H+═H2O 表示,故A错误;
B.氢氧化铁为难溶性碱,书写离子方程式不能拆,所以Fe(OH)3溶液和硫酸反应不能用OH-+H+═H2O 表示,故B错误;
C.氢氧化钡与硫酸反应除了生成水外还生成硫酸钡沉淀,所以不能用OH-+H+═H2O 表示,故C错误;
D.KOH溶液和稀硝酸反应实质为氢离子与氢氧根离子反应生成水,离子方程式表示为:OH-+H+═H2O,故D正确;
故选:D.
点评 本题考查了离子方程式的书写,明确离子方程式书写的方法和意义是解题关键,题目难度不大.

练习册系列答案
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案 名题金卷系列答案
名题金卷系列答案
相关题目
4.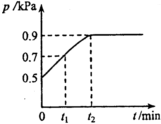 在1.0L密闭容器中放入0.10mol X,在一定温度下发生反应:X(g)?Y(g)+Z(g)△H<0,容器内气体总压强p随反应时间t的变化关系如图所示.以下分析不正确的是( )
在1.0L密闭容器中放入0.10mol X,在一定温度下发生反应:X(g)?Y(g)+Z(g)△H<0,容器内气体总压强p随反应时间t的变化关系如图所示.以下分析不正确的是( )
 在1.0L密闭容器中放入0.10mol X,在一定温度下发生反应:X(g)?Y(g)+Z(g)△H<0,容器内气体总压强p随反应时间t的变化关系如图所示.以下分析不正确的是( )
在1.0L密闭容器中放入0.10mol X,在一定温度下发生反应:X(g)?Y(g)+Z(g)△H<0,容器内气体总压强p随反应时间t的变化关系如图所示.以下分析不正确的是( )| A. | 从反应开始到t1时的平均反应速率v(X)=$\frac{0.04}{{t}_{1}}$mol(L•min) | |
| B. | 该温度下此反应的平衡常数K=$\frac{0.32}{{t}_{2}}$ | |
| C. | 欲提高平衡体系中Y的含量,可降低体系温度或减少Z的量 | |
| D. | 其他条件不变,再充入0.10 mol气体X,平衡正向移动,X的转化率增大 |
1.在理论上不能用于设计原电池的化学反应是 ( )
| A. | NaCl(aq)+AgNO3(aq)=AgCl(s)+NaNO3(aq )△H<0 | |
| B. | 2KMnO4(s)=2K2MnO4(s)+MnO2(s)+O2(g)△H>0 | |
| C. | 2FeCl3(aq)+Fe(s)=3FeCl3(aq)△H<0 | |
| D. | 2H2(g)+O2(g)=2H2O (l)△H<0 |
2.下列各组元素中,按最高正化合价递减的顺序排列的是( )
| A. | C、N、Cl | B. | F、O、H | C. | S、P、Si | D. | Na、Mg、Al |
3.在下列变化过程中,被破坏的作用力正确的是( )
| A. | 干冰升华--共价键 | B. | 二氧化硅熔融--分子间作用力 | ||
| C. | 氢氧化钠熔融--离子键、共价键 | D. | 硫酸氢钠溶于水--离子键、共价键 |
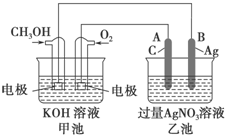 如图是一个化学过程的示意图.已知甲池的总反应式为2CH3OH+3O2+4KOH═2K2CO3+6H2O
如图是一个化学过程的示意图.已知甲池的总反应式为2CH3OH+3O2+4KOH═2K2CO3+6H2O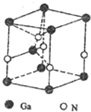 碳、氮元素及其化合物在生产、生活和科学研究等方面有着重要的作用研究它们的结构与性质意义重大.请回答下列有关问题:
碳、氮元素及其化合物在生产、生活和科学研究等方面有着重要的作用研究它们的结构与性质意义重大.请回答下列有关问题: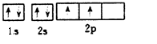 .
.