题目内容
14.如图图元素周期表的一部分,下列说法中正确的是( )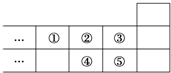
| A. | 元素①位于第2周期第ⅣA族 | |
| B. | ①的气态氢化物与⑤的气态氢化物反应产生白烟 | |
| C. | 元素的氧化物对应水化物的酸性一定是:⑤>④ | |
| D. | 元素的最高正化合价:③=⑤ |
分析 由元素在周期表中位置,可知①为N、②为O、③为F、④为S、⑤为Cl.
A.N元素位于第二周期VA族;
B.氨气与HCl反应生成氯化铵固体;
C.非金属性越强,最高价含氧酸的酸性越强,不是最高价含氧酸则不一定;
D.F元素没有正化合价.
解答 解:由元素在周期表中位置,可知①为N、②为O、③为F、④为S、⑤为Cl.
A.N元素位于第二周期VA族,故A错误;
B.氨气与HCl反应生成氯化铵固体,有白烟产生,故B正确;
C.应描述为:元素的最高价氧化物对应水化物的酸性一定是:⑤>④,不是最高价含氧酸则不一定,如硫酸为强酸,次氯酸为弱酸,故C错误;
D.F元素电负性最大,所以没有正化合价,故D错误,
故选B.
点评 本题考查元素周期表与元素周期律,难度不大,侧重对元素周期律的考查,注意元素化合价的特殊性.

练习册系列答案
相关题目
4.下列各组给定原子序数的元素,不能形成原子数之比为1:1稳定化合物的是( )
| A. | 3和17 | B. | 1和8 | C. | 11和8 | D. | 7和12 |
5.下列物质的分类合理的是( )
| A. | 氧化物:CO2、NO、SO2、 | B. | 碱:NaOH、KOH、Na2CO3 | ||
| C. | 铵盐:NH4Cl、NH4NO3、NH3•H2O | D. | 碱性氧化物:Na2O、CaO、Al2O3 |
2.下列化学用语表达正确的是( )
| A. | 实验室用大理石与醋酸反应制取二氧化碳:CaCO3+2H+=Ca2++CO2↑+H2O | |
| B. | 氯乙酸与足量氢氧化钠溶液共热:CH2ClCOOH+OH-→CH2ClCOO-+H2O | |
| C. | 苯酚钠溶液中通入少量二氧化碳:2C6H5O-+CO2+H2O→2C6H5OH+CO32- | |
| D. | 用新制Cu(OH)2检验乙醛中的醛基:CH3CHO+2Cu(OH)2+NaOH $\stackrel{△}{→}$CH3COONa+Cu2O↓+3H2O |
9.下列化学用语表达正确的是( )
| A. | 一氯乙烷的结构式CH3Cl | B. | 丁烷的结构简式CH3CH2CH2CH3 | ||
| C. | 四氯化碳的电子式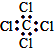 | D. | 乙烷的分子式 (CH3)2 |
19.X元素原子的质量数为m,核内中子数为n,则Wg X2+离子含有的电子的物质的量约为( )
| A. | $\frac{m+n+2}{w}$mol | B. | $\frac{m-n+2}{m}$ mol | C. | $\frac{m+n-2}{m}$ mol | D. | $\frac{W(m-n-2)}{m}$mol |
6.如图,在锌、铜和硫酸组成的原电池中,负极发生的反应是( )
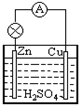

| A. | Zn-2e-=Zn2+ | B. | Cu-2e-=Cu2+ | C. | 2H++2e-=H2↑ | D. | Cu2++2e-=Cu |
3.下表是元素周期表的一部分,表中的每个字母代表一种短周期元素.
(1)a元素和c元素可以形成的气体,其化学式为NH3;
(2)e的元素符号是Na;
(3)b元素原子的最外层电子数为4;
(4)b、c、d三种元素的非金属性逐渐增强(填“减弱”或“增强”);
(5)d元素和f元素均可形成气态氢化物,其稳定性为H2d大于H2f (填“大于”或“小于”).
(6)上述七种元素的最高价氧化物的水合物中,碱性最强的是NaOH,酸性最强的是HClO4,既有酸性又有碱性的是Al(OH)3(写化学式)
| 族 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | a | |||||||
| 2 | b | c | d | |||||
| 3 | e | g | f | |||||
(2)e的元素符号是Na;
(3)b元素原子的最外层电子数为4;
(4)b、c、d三种元素的非金属性逐渐增强(填“减弱”或“增强”);
(5)d元素和f元素均可形成气态氢化物,其稳定性为H2d大于H2f (填“大于”或“小于”).
(6)上述七种元素的最高价氧化物的水合物中,碱性最强的是NaOH,酸性最强的是HClO4,既有酸性又有碱性的是Al(OH)3(写化学式)
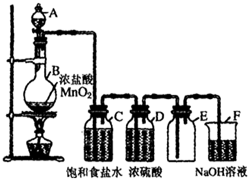 小明同学为了制得纯净而干燥的氯气,对课本上的实验方案进行了改进.在发生装置和收集装置之间添加了盛有饱和食盐水和浓硫酸的洗气瓶(如图).请回答:
小明同学为了制得纯净而干燥的氯气,对课本上的实验方案进行了改进.在发生装置和收集装置之间添加了盛有饱和食盐水和浓硫酸的洗气瓶(如图).请回答: