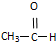题目内容
4.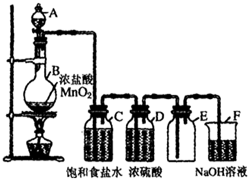 小明同学为了制得纯净而干燥的氯气,对课本上的实验方案进行了改进.在发生装置和收集装置之间添加了盛有饱和食盐水和浓硫酸的洗气瓶(如图).请回答:
小明同学为了制得纯净而干燥的氯气,对课本上的实验方案进行了改进.在发生装置和收集装置之间添加了盛有饱和食盐水和浓硫酸的洗气瓶(如图).请回答:(1)饱和食盐水的作用是吸收氯化氢杂质气体.
(2)请写出B中发生反应的化学方程式MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(3)请写出F中发生反应的离子方程式:Cl2+2OH-=Cl-+ClO-+H2O.
(4)为了检查氯气在制取过程中是否泄漏,你选择的试剂是③(填序号),相关反应的化学方程式为2I-+Cl2=I2+2Cl-.
①紫色石蕊试液 ②品红试液 ③湿润的淀粉碘化钾试纸.
分析 (1)制备的氯气含有氯化氢和水蒸气,通过饱和食盐水减少氯气溶解度,吸收氯化氢;
(2)B中的反应是二氧化锰和浓盐酸加热反应生成氯化锰、氯气和水;
(3)F中的反应是吸收剩余氯气,防止剩余氯气排放到空气中污染空气;
(4)①氯气遇到石蕊试液会出现先变红色后褪色;
②品红试液遇到氯气会褪色;
③氯气和碘化钾反应生成碘单质遇到淀粉变蓝色;
解答 解:(1)制备的氯气含有氯化氢和水蒸气,通过饱和食盐水减少氯气溶解度,吸收氯化氢气体,
故答案为:吸收氯化氢杂质气体;
(2)B中的反应是二氧化锰和浓盐酸加热反应生成氯化锰、氯气和水,反应的化学方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(3)F中的反应是吸收剩余氯气,防止剩余氯气排放到空气中污染空气,反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(4)①氯气遇到石蕊试液会出现先变红色后褪色,试液不宜操作,故①不选;
②品红试液遇到氯气会褪色,试液不宜操作,故②不选;
③氯气和碘化钾反应生成碘单质遇到淀粉变蓝色,利用湿润的试纸现象明显,可以检验,故③正确;
反应的离子方程式为:2I-+Cl2=I2+2Cl-,
故答案为:③,2I-+Cl2=I2+2Cl-,
点评 本题考查了实验室制备氯气的方法和装置分析判断,主要是化学方程式、离子方程式书写,杂质气体的除去的试剂选择,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
14.如图图元素周期表的一部分,下列说法中正确的是( )

| A. | 元素①位于第2周期第ⅣA族 | |
| B. | ①的气态氢化物与⑤的气态氢化物反应产生白烟 | |
| C. | 元素的氧化物对应水化物的酸性一定是:⑤>④ | |
| D. | 元素的最高正化合价:③=⑤ |
12.下列叙述正确的是( )
| A. | CHF=CHCl存在顺反异构 | |
| B. | 结构不同,性质相同,化学式相同的物质互称同分异构体 | |
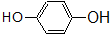
| C. |  和 和 均是芳香烃, 均是芳香烃,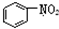 既是芳香烃又是芳香化合物 既是芳香烃又是芳香化合物 | |
| D. |  和 和 分子组成相差一个-CH2-,因此是同系物关系 分子组成相差一个-CH2-,因此是同系物关系 |
19.一定条件下,卤代烃和金属钠能发生伍兹反应:R-X+2Na+R′-X→R-R′+2NaX,反应中有C-X键的断裂和C-C键的形成.据此,以下卤代烃伍兹反应的可能产物(不考虑NaX)及命名不合理的是( )
| A. | 一氯甲烷和2-氯丙烷:正丁烷 | |
| B. | 2,2-二甲基-1-氯丙烷与一氯甲烷:2,2-二甲基丁烷 | |
| C. | 1,5-二氯戊烷:环戊烷 | |
| D. | 一氯甲烷和四氯化碳:2,2-二甲基丙烷 |
9.在2A(g)+B(g)═3C(g)+4D(g)反应中,表示该反应速率最快的是( )
| A. | vA=0.5mol•L-1•s-1 | B. | vB=0.3 mol•L-1•s-1 | ||
| C. | vC=0.8 mol•L-1•s-1 | D. | vD=1.0 mol•L-1•s-1 |
16.如图是某有机物分子的简易球棍模型.下列关于该有机物的说法中错误的是( )


| A. | 分子式为C3H7O2N | |
| B. | 该有机物能发生缩聚反应 | |
| C. | 能通过聚合反应生成高分子化合物 | |
| D. | 具有相同官能团的该有机物的同分异构体还有两种 |
13.已知化合物NH5的结构和NH4Cl相似,下列关于NH5的下列说法中正确的是( )
| A. | NH5是共价化合物 | |
| B. | NH5的电子式为NH4+[:H]- | |
| C. | NH5中氢元素呈价+1和-1价 | |
| D. | NH5与水发生氧化还原反应,置换出氢气 |
 ,
, .两种离子中,半径较小的是Na+(填离子符号).
.两种离子中,半径较小的是Na+(填离子符号). B2C2
B2C2 .
. ③
③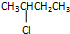
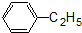 ⑤
⑤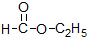 ⑥
⑥