题目内容
19.X元素原子的质量数为m,核内中子数为n,则Wg X2+离子含有的电子的物质的量约为( )| A. | $\frac{m+n+2}{w}$mol | B. | $\frac{m-n+2}{m}$ mol | C. | $\frac{m+n-2}{m}$ mol | D. | $\frac{W(m-n-2)}{m}$mol |
分析 根据质子数=质量数-中子数计算X原子的质子数,阳离子中核外电子数=质子数-电荷数,根据n=$\frac{m}{M}$计算Wg X2+离子,进而计算含有电子的物质的量.
解答 解:X原子的质子数=m-n,X2+离子的核外电子数=m-n-2,Wg X2+离子含有的电子的物质的量=$\frac{Wg}{mg/mol}$×(m-n-2)=$\frac{W(m-n-2)}{m}$mol,故选D.
点评 本题考查原子的构成及粒子数量关系、物质的量有关计算等,关键是计算离子核外电子数目,比较基础.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.某恒容密闭容器中发生可逆反应:A(s)+B(g)?C(g),能说明该反应已达到平衡状态的是( )
| A. | 容器内A、B、C三者共存 | B. | vC=vB | ||
| C. | 容器内压强不再变化 | D. | 气体的密度不再变化 |
7.下列说法不能作为比较卤族元素非金属强弱依据的是( )
| A. | F2、Cl2、Br2、I2跟氢气反应的激烈程度逐渐减小 | |
| B. | HF、HCl、HBr、HI的热稳定性依次减小 | |
| C. | F-、Cl-、Br-、I-的还原性依次增强 | |
| D. | HF、HCl、HBr、HI水溶液的酸性依次增强 |
14.如图图元素周期表的一部分,下列说法中正确的是( )
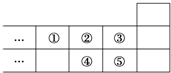

| A. | 元素①位于第2周期第ⅣA族 | |
| B. | ①的气态氢化物与⑤的气态氢化物反应产生白烟 | |
| C. | 元素的氧化物对应水化物的酸性一定是:⑤>④ | |
| D. | 元素的最高正化合价:③=⑤ |
11.下列化学用语书写正确的是( )
| A. | 氯离子的结构示意图: | |
| B. | CCl4的电子式: | |
| C. | 中子数为20的氯原子:${\;}_{17}^{20}$Cl | |
| D. | 用电子式表示氯化氢分子的形成过程:H+ → → |
8.下列电子式表示正确的是( )
| A. | Cl2: | B. | NaCl: | C. | NaOH: | D. | H2O: |
9.在2A(g)+B(g)═3C(g)+4D(g)反应中,表示该反应速率最快的是( )
| A. | vA=0.5mol•L-1•s-1 | B. | vB=0.3 mol•L-1•s-1 | ||
| C. | vC=0.8 mol•L-1•s-1 | D. | vD=1.0 mol•L-1•s-1 |
 .
. ,EB4
,EB4 .
.