题目内容
近年我国首创以Al--空气--海水为能源的新型电池,以海水为电解液.靠空气中的氧使铝不断氧化而产生电流.其工作时电极总反应式为:4Al+3O2+6H2O=4Al(OH)3;请判断:
(1)原电池的负极是 ;
(2)工作时原电池的两极反应:A.负极 ;B.正极 ;
(3)工作时原电池正极附近pH (增大,减小,不变).
(1)原电池的负极是
(2)工作时原电池的两极反应:A.负极
(3)工作时原电池正极附近pH
考点:原电池和电解池的工作原理
专题:电化学专题
分析:铝是活泼金属,易被氧化而失去电子,应做原电池的负极,电极反应式为Al-3e-=Al3+,正极上氧气得电子发生还原反应:O2+2H2O+4e-=4OH-.
解答:
解:(1)铝是活泼金属,易被氧化而失去电子,应做原电池的负极,故答案为:Al;
(2)原电池工作时,负极发生反应为Al-3e-=Al3+,正极上氧气得电子发生还原反应,电极反应式为O2+2H2O+4e-=4OH-,
故答案为:Al-3e-=Al3+,O2+2H2O+4e-=4OH-;
(3)正极上氧气得电子生成氢氧根离子,所以正极负极PH增大;
故答案为:增大.
(2)原电池工作时,负极发生反应为Al-3e-=Al3+,正极上氧气得电子发生还原反应,电极反应式为O2+2H2O+4e-=4OH-,
故答案为:Al-3e-=Al3+,O2+2H2O+4e-=4OH-;
(3)正极上氧气得电子生成氢氧根离子,所以正极负极PH增大;
故答案为:增大.
点评:本题考查了原电池原理,明确正负极上得失电子及反应类型即可解答,题目难度不大.

练习册系列答案
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
相关题目
下列离子方程式正确的是( )
| A、Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+═Fe3++3H2O |
| B、向NaHCO3溶液中加入少量Ca(OH)2溶液:2HCO+Ca2++2OH-═CaCO3↓+CO32-+2H2O |
C、向苯酚溶液中滴加Na2CO3溶液: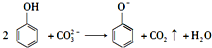 |
| D、向氯化亚铁溶液中滴加稀硝酸:Fe2++2H++NO═Fe3++NO2↑+H2O |
将2mol SO2和1mol O2充入一容积固定的密闭容器中,在一定条件下发生反应:2SO2(g)+O2(g)?2SO3(g),下列哪些量不再变化时,并不能说明化学反应已达平衡状态( )
| A、混合气体的密度 |
| B、混合气体的压强 |
| C、混合气体的总物质的量 |
| D、混合气体的平均相对分子质量 |
下列离子方程式错误的是( )
| A、小苏打溶液中加入过量的烧碱溶液:HCO3-+OH-=CO32-+H2O |
| B、澄清石灰水中通入过量的CO2:CO2+OH-=HCO3- |
| C、Cl2与水反应生成盐酸和次氯酸Cl2+H2O=2H++Cl-+ClO- |
| D、硫酸与氢氧化钡溶液反应:2H++2OH-+Ba2++SO42-=2H2O+BaSO4↓ |

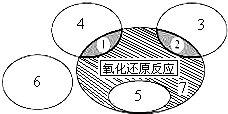 (1)如图是课本中“四种基本反应类型与氧化还原反应的关系”图,“H2+CuO
(1)如图是课本中“四种基本反应类型与氧化还原反应的关系”图,“H2+CuO