题目内容
有下列六种物质:①N2、②Ne、③CO2、④SiO2、⑤MgCl2、⑥NH4Cl请回答以下问题:
没有化学键的物质是 (填编号,下同),既含有共价键又含有离子键的物质是 .以上六种物质在融化时只克服共价键的是 (填编号).③④⑤三种物质按熔点由高到低排列 (用编号表示).写出CO2的电子式: .
没有化学键的物质是
考点:化学键,离子化合物的结构特征与性质,共价键的形成及共价键的主要类型
专题:化学键与晶体结构
分析:一般来说,金属元素与非金属元素之间形成离子键,同种非金属元素之间形成非极性键,不同非金属元素之间形成极性键,以此判断;
根据物质含有的化学键类型以及变化类型进行判断;
一般情况下,不同类型的晶体,熔点:原子晶体>离子晶体>分子晶体;
CO2是共价化合物,其结构式为O=C=O,碳原子和氧原子之间有2对电子.
根据物质含有的化学键类型以及变化类型进行判断;
一般情况下,不同类型的晶体,熔点:原子晶体>离子晶体>分子晶体;
CO2是共价化合物,其结构式为O=C=O,碳原子和氧原子之间有2对电子.
解答:
解:①N2中含N、N之间的共价键,②Ne是单原子分子,不存在化学键,③CO2中含C、O之间的共价键,④SiO2中含Si、O之间的共价键,⑤MgCl2中只含离子键,⑥NH4Cl含离子键和N、H之间的共价键;
①N2融化时不破坏共价键,克服分子间作用力,②Ne融化时没有化学键破坏,克服分子间作用力,③CO2融化时不破坏共价键,克服分子间作用力,④SiO2融化时共价键破坏,⑤MgCl2融化时离子键破坏,⑥NH4Cl融化时离子键破坏;
③CO2为分子晶体,④SiO2为原子晶体,⑤MgCl2为离子晶体,不同类型的晶体,熔点:原子晶体>离子晶体>分子晶体,所以④⑤③;
CO2是共价化合物,其结构式为O=C=O,碳原子和氧原子之间有2对电子,其电子式为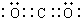 ,
,
故答案为:②;⑥;④;④⑤③;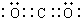 .
.
①N2融化时不破坏共价键,克服分子间作用力,②Ne融化时没有化学键破坏,克服分子间作用力,③CO2融化时不破坏共价键,克服分子间作用力,④SiO2融化时共价键破坏,⑤MgCl2融化时离子键破坏,⑥NH4Cl融化时离子键破坏;
③CO2为分子晶体,④SiO2为原子晶体,⑤MgCl2为离子晶体,不同类型的晶体,熔点:原子晶体>离子晶体>分子晶体,所以④⑤③;
CO2是共价化合物,其结构式为O=C=O,碳原子和氧原子之间有2对电子,其电子式为
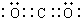 ,
,故答案为:②;⑥;④;④⑤③;
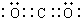 .
.
点评:本题考查化学键的类型以及变化时的化学键的变化,注意物理变化与化学变化的区别,以及化学键与分子间作用力的区别.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
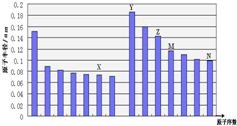 如图是部分短周期元素原子半径与原子序数的关系图,下列说法不正确的是( )
如图是部分短周期元素原子半径与原子序数的关系图,下列说法不正确的是( )| A、N、Z两种元素的离子半径相比前者较大 |
| B、M、N两种元素的气态氢化物的稳定性相比后者较强 |
| C、X与M两种元素组成的化合物能与水反应生成相应的酸 |
| D、工业上常用电解Y和N形成的化合物的熔融态制取Y的单质 |
合金在生产及科研中具有广泛的应用.下列物质不属于合金的是( )
| A、铝箔 | B、青铜 | C、铁板 | D、不锈钢 |

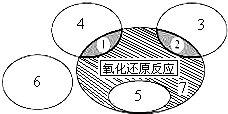 (1)如图是课本中“四种基本反应类型与氧化还原反应的关系”图,“H2+CuO
(1)如图是课本中“四种基本反应类型与氧化还原反应的关系”图,“H2+CuO